সংকেত - NH₃ আনবিক ওজন - 17
নাইট্রোজেন ঘটিত উদ্ভিজ বা প্রাণীজ পদার্থের ( মূত্র ) ব্যাকটেরিয়া ঘটিত বিয়োজনের ফলে এমোনিয়া উৎপন্ন হয় । তাই প্রস্রাবাগারে এমোনিয়ার গন্ধ পাওয়া যায় ।
পরীক্ষাগারে এমোনিয়া প্রস্তুতির নীতি :
এমোনিয়াম ক্লোরাইড বা এমোনিয়াম সালফেটকে চুন বা শুস্ক কলিচুন বা কস্টিক সোডা সহ উত্তপ্ত করলে এমোনিয়া উৎপন্ন হয় ।
রাসায়নিক সমীকরণ :
তাপ
1) 2NH₄Cl + CaO ⟶ 2NH₃ + CaCl₂ + H₂O
তাপ
2) 2NH₄Cl + Ca(OH)₂ ⟶ 2NH₃ + CaCl₂ + 2H₂O
বিক্রিয়ার শর্ত : তাপ প্রয়োগে বিক্রিয়া ঘটে ।
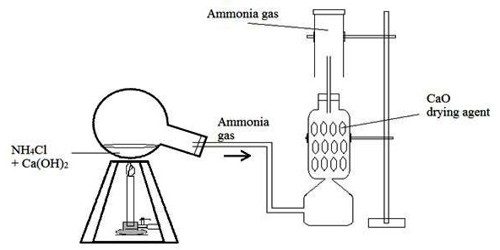
পদ্ধতি :
এমোনিয়াম ক্লোরাইড ও কলিচুনের মিশ্রণকে ( 1 ։ 3 ) গোলতল ফ্লাস্কে বুনসেন বার্নারের সাহায্যে উত্তপ্ত করলে এমোনিয়া গ্যাস উৎপন্ন হয়ে নির্গম নল দিয়ে বেরিয়ে আসে এবং চুন (CaO) স্তম্ভের মধ্যে গিয়ে জলীয় বাস্প মুক্ত হয় এবং অবশেষে শুস্ক এমোনিয়া গ্যাস বায়ুর নিম্ন অপসারণ দ্বারা উপুড় করা গ্যাস জারে সংগৃহিত হয় ।
এমোনিয়া সুস্ককরণ :
এমোনিয়া ক্ষারীয় হওয়ায় অপর জলশোসক ক্ষারীয় পদার্থ পোড়া চুন(CaO) দ্বারা শুস্ক করা হয় ।
গাঢ় H₂SO₄ বা P₂O₅ বা অনার্দ্র CaCl₂ দ্বারা শুস্ক করা যায় না । কারণ এমোনিয়া ক্ষার ধর্মী হওয়ায় এদের সঙ্গে বিক্রিয়া করে যায় ।
1) 2NH₃ + H₂SO₄ ⟶ (NH₄)₂SO₄(এমোনিয়াম সালফেট )
2)6 NH₃+ P₂O₅ +3 H₂O ⟶ (NH₄)₃PO₄ (এমোনিয়াম ফসফেট )
3) 8NH₃ + CaCl₂ ⟶ CaCl₂.8NH₃(এক প্রকার যুত যৌগ )
এমোনিয়ার ধৰ্ম :
ভৌত ধৰ্ম - 1) এমোনিয়া তীব্র ঝাঁঝালো গন্ধযুক্ত , বায়ু অপেক্ষা হালকা গ্যাস । এর বাস্প ঘণত্ব 8.5 |
2) বায়ুমণ্ডলীয় চাপে - 33.4⁰C উষ্নতায় বর্ণহীন তরলে পরিণত হয় । একে তরল এমোনিয়া বলে ।
3) এমোনিয়া জলে অতিশয় দ্রাব্য এবং এর জলীয় দ্রবণ ক্ষারধর্মী ।
এমোনিয়ার রাসায়নিক ধৰ্ম :
1) ক্ষার ধৰ্ম - এর জলীয় দ্রবণ মৃদু ক্ষার ধর্মী । জলে দ্রবীভূত হলে ক্ষার উৎপন্ন হয় ।
NH₃ + H₂O ⟶ NH₄OH(এমোনিয়াম হাইড্রো অক্সাইড ) এসিডের সঙ্গে বিক্রিয়ায় লবণ গঠন করে । এমোনিয়া হাইড্রোজেন ক্লোরাইডের(HCl)সঙ্গে বিক্রিয়ায় কঠিন এমোনিয়াম ক্লোরাইডের( NH₄Cl)সাদা ধুঁয়া উৎপন্ন করে ।
এই বিক্রিয়া দ্বারা এমোনিয়া কে সনাক্ত করা যায় ।
সালফিউরিক এসিডের সান সঙ্গে বিক্রিয়া করে এমোনিয়াম সালফেট উৎপন্ন করে ।
2NH₃ + H₂SO₄⟶ (NH₄)₂SO₄
নাইট্রিক এসিডের সঙ্গে বিক্রিয়া করে এমোনিয়াম নাইট্রেট লবন গঠন করে ।
NH₃+HNO₃ ⟶NH₄NO₃
2) বিজারণ ধৰ্ম :
উত্তপ্ত কপার অক্সাইড এর মধ্য দিয়ে এমোনিয়া চালনা করলে কপার অক্সিডেকে বিজারিত করে লাল কপার এ পরিণত করে এবং নিজে জারিত হয়ে নাইট্রোজেনে পরিণত হয় । এই বিক্রিয়াতে প্রমাণিত হয় এমোনিয়াতে নাইট্রোজেন আছে ।
3CuO + 2NH₃ ⟶ 3Cu + N₂ +3H₂O
একই রকম বিক্রিয়া ঘটে লেড অক্সাইড এর সঙ্গে ,
3PbO + 2NH₃ ⟶ + N₂ 3H₂O
এমোনিয়ার জারণ :
অ্যামোনিয়া নিজে জ্বলে না অপরকে জ্বলতে ও সাহায্য করে না , কিন্তূ অক্সিজেনের উপস্থিতিতে অ্যামোনিয়া গ্যাসে আগুন ধরালে জারিত হয়ে নাইট্রোজেন উৎপন্ন করে ।
4NH₃ + 3O₂ ⟶ 2 N₂ + 6 H₂O
অ্যামোনিয়া ও অতিরিক্ত অক্সিজেনের মিশ্রণকে 700⁰ C উস্নতায় উত্তপ্ত Pt তারজালির ওপর দিয়ে অতি দ্রুত পাঠালে
অ্যামোনিয়া জারিত হয়ে নাইট্রিক অক্সাইড উৎপন্ন হয় ।
4NH₃ + 6O₂ ⟶ 4NO + 6H₂O + তাপ
সোডিয়াম ধাতুর সঙ্গে বিক্রিয়া :
প্রায় 300⁰ C তাপমাত্রায় উত্তপ্ত সোডিয়ামের ওপর দিয়ে অ্যামোনিয়া চালনা করলে সোডামাইড ও হাইড্রোজেন গ্যাস উৎপন্ন হয় । এর দ্বারা প্রমাণিত হয় অ্যামোনিয়া তে হাইড্রোজেন আছে ।
2 Na + 2NH₃ ⟶ 2NaNH₂ + H₂
সোডামাইড এর সঙ্গে জল যোগ করলে পুনারায় অ্যামোনিয়া পাওয়া যায় ।
NaNH₂ + H₂O ⟶ NaOH + NH₃
ধাতব লবনের সঙ্গে বিক্রিয়া :
অ্যালুমিনিয়াম ক্লোরাইড এর জলীয় দ্রবণে NH₄OH এর দ্রবণ যোগ করলে অ্যালুমিনিয়াম হাইড্রো অক্সাইড এর সাদা অধঃক্ষেপ পড়ে ।
AlCl₃ + 3NH₄OH ⟶ Al(OH)₃ + 3NH₄Cl
হলুদ বর্ণের ফেরিক ক্লোরাইড দ্রবণে NH₄OH দ্রবণ যোগ করলে বাদামি বর্ণের ফেরিক হাইড্রো অক্সাইড অধঃক্ষিপ্ত হয় ।
FeCl₃ + 3NH₄OH ⟶ Fe(OH)₃ + 3NH₄Cl
নেসলার বিকারকের সঙ্গে বিক্রিয়া:
পটাসিয়াম মারকিউরিক আয়োডাইডের ( K₂HgI₄) ক্ষারীয় দ্রাবনকে নেসলার বিকারক বলে । নেসলার বিকারক অ্যামোনিয়া র সান সংস্পর্শে আসলে তামাটি বর্ণ ধারণ করে ।
লাইকার অ্যামোনিয়া :
উচ্চ চাপে প্রায় 35 % অ্যামোনিয়া গ্যাসকে জলে দ্রবীভূত করা হয় । একে লাইকার অ্যামোনিয়া বলে । লাইকার অ্যামোনিয়া যুক্ত বোতলের ছিপি খুললে উচ্চ চাপে দ্রবীভূত অ্যামোনিয়া ফোয়ারার মত্ বেরিয়ে আসে । অ্যামোনিয়া গ্যাস চোখের পক্ষে খুব ক্ষতিকারক ,চোখে পড়লে দৃষ্টি শক্তি নষ্ট হয়ে যেতে পারে । তাই বোতলের ছিপি খোলার আগে বোতলটিকে বরফ জলে শীতল করলে দ্রাব্যতা বৃদ্ধি পায় এবং অ্যামোনিয়া ছিটকে বেরিয়ে আসে না ।
হিমায়ক রূপে তরল অ্যামোনিয়ার ব্যবহার :
তরল অ্যামোনিয়া র বাষ্পীভবনের লিনতাপ অনেক বেশি । তাই তরল অ্যামোনিয়া যখন বাষ্পী ভূত হয় তখন পারিপার্শ থেকে প্রচুর তাপ শোষিত হয় । এই জন্য রেফ্রিজারেটর ,কোল্ডস্টোরেজ ও বরফ তৈরির কারখানায় ব্যবহৃত হয় ।
অ্যামোনিয়ার শিল্প উৎপাদন ( হেবার পদ্ধতি ):
আয়রন চূর্ণ অনুঘটক এবং K₂O ও Al₂O₃ উদ্দীপক রূপে ব্যবহার করে বিশুদ্ধ ও শুস্ক নাইট্রোজেন ও হাইড্রোজেনের মিশ্রণকে 200 বায়ু মন্ডলীয় চাপে 450⁰ C উষ্নতায় উত্তপ্ত করলে অ্যামোনিয়া উৎপন্ন হয় ।
N₂ + 3H₂ ⇌2 NH₃ +তাপ
শিল্পে অ্যামোনিয়ার ব্যবহার :
অ্যামোনিয়াম সালফেট ,অ্যামোনিয়াম নাইট্রেট ,অ্যামোনিয়াম ফসফেট প্রভৃতি অজৈব সার এবং জৈব সার ইউরিয়া প্রস্তুতিতে ব্যবহৃত হয় ।
ইউরিয়ার (H₂NCONH₂ )শিল্প উৎপাদন :
উচ্চ চাপে ( প্রায় 175 বায়ুমণ্ডলীয় চাপ ) ও 170 - 190⁰C উষ্নতায় বদ্ধ পাত্রে তরল অ্যামোনিয়া ও কার্বন -ডাই -অক্সাইড র বিক্রিয়া ঘটিয়ে প্রথমে অ্যামোনিয়াম কার্বামেট ও পরে এটি বিয়োজিত হয়ে ইউরিয়া ও জলে পরিণত হয় ।
2 NH₃ + CO₂ ⇌ H₂NCOONH₄ ( অ্যামোনিয়াম কার্বামেট)
H₂NCOONH₄ ⇌ H₂NCONH₂ + H₂O
ইউরিয়ার ব্যবহার :
নাইট্রোজেন ঘটিত জৈব সার রূপে ,কালা জ্বরের ঔষধ ইউরিয়া স্টিবামিন ও ঘুমের ঔষধ বারবিটিউরেট নামক জৈব যৌগ প্রস্তুতিতে ব্যবহৃত হয় । নাইট্রসেলুলেজ ,সেলোফেন ও রেয়ন প্রভৃতির শিল্প উৎপাদনে ইউরিয়া ব্যবহৃত হয় ।
হাইড্রোজেন সালফাইড বা সালফিউরেটেড হাইড্রোজেন :
সংকেত - H₂S , আনবিক ওজন - 34
হাইড্রোজেন সালফাইড এর পরীক্ষাগার প্রস্তুতি :

নীতি ও শর্ত :
সাধারণ উষ্নতায় ফেরাস সালফাইড (FeS ) ও লঘু সালফিউরিক এসিড(H₂SO₄)এর বিক্রিয়ায় H₂S গ্যাস উৎপন্ন হয় |
FeS + H₂SO₄(লঘু ) ⟶ FeSO₄ + H₂S
পদ্ধতি - উল্ফ বোতলের সাহায্যে পৰীক্ষাগারে H₂S তৈরি করা হয় ।
গ্যাস সংগ্রহ - গ্যাসটি বায়ু অপেক্ষা ভারী বলে বায়ুর উর্ধ অপসারণ দ্বারা সংগ্রহ করা হয় ।
H₂S এর শুস্ক করণ - H₂S কে P₂O₅ দ্বারা শুষ্ক করা হয় ।
H₂S প্রস্তুতিতে গাঢ় H₂SO₄ ব্যবহার করা হয় না , কারণ গাঢ় H₂SO₄ তীব্র জারক পদার্থ যা উৎপন্ন H₂S কে জারিত করে সালফারে করে ,ফলে H₂S পাওয়া যায় না ।
H₂S + H₂SO₄ ⟶ S + SO₂ + 2H₂O
লঘু H₂SO₄ এর জারণ ক্ষমতা না থাকার দরুন লঘু H₂SO₄ ব্যবহার করা হয় ।
হাইড্রোজেন সালফাইড এর ধৰ্ম
ভৌত ধৰ্ম :
H₂S পচা ডিমের গন্ধযুক্ত , বর্ণহীন বিষাক্ত গ্যাস । এই গ্যাস বায়ু অপেক্ষা 1.2 গুন্ ভারী । ঠান্ডা জলে দ্রাব্য কিন্তূ গরম জলে অদ্রাব্য ।
হাইড্রোজেন সালফাইডের রাসায়নিক ধৰ্ম :
H₂S এর এসিড ধৰ্ম - H₂S এর জলীয় দ্রবণ মৃদু অ্যাসিড ধর্মী জলীয় দ্রবণে আয়োনিত হয়ে বাই সালফাইড (HS⁻) ও সালফাইড ( S²⁻) আয়ন উৎপন্ন করে ।
H₂S + H₂O ⇌ H₃O⁺ + HS⁻ ; H₂S + 2H₂O ⇌ H₃O⁺ + S²⁻
ক্ষারের সঙ্গে বিক্রিয়া :
H₂S ও NaOH বিক্রিয়া করে সোডিয়াম বাই সাল ফাইড ও সোডিয়াম সাল ফাইড লবণ উৎপন্ন করে ।
H₂S +NaOH ⟶ NaHS + H₂O ; H₂S +2NaOH ⟶ Na₂S + 2H₂O
H₂S এর জারণ :
H₂S নিজে দাহ্য নয় দহন সহায়ক নয় ।বায়ুতে বা অক্সিজেনে এটি নীল শিখা সহ জ্বলে । অপর্যাপ্ত অক্সিজেনে সালফার উৎপন্ন হয় কিন্তু পর্যাপ্ত অক্সিজেনে সালফার ডাই অক্সাইড উৎপন্ন হয় ।
2H₂S + O₂ ⟶ 2S + 2H₂O ; 2H₂S +3 O₂ ⟶ 2SO₂ + 2H₂O
H₂S এর বিজারণ ধৰ্ম :
এসিড যুক্ত পটাশিয়াম ডাইক্রোমেট( K₂Cr₂O₇) এর কমলা বর্ণের দ্রবনের মধ্য দিয়ে H₂S চালনা করলে ডাইক্রোমেটকে বিজারিত করে সবুজ বর্ণের ক্রমিক লবন তৈরি করে ।
K₂Cr₂O₇ + 3H₂S + 4H₂SO₄ ⟶ Cr₂(SO₄)₃ + K₂SO₄ + 3S + 7H₂O
ধাতব লবনের সঙ্গে H₂S এর বিক্রিয়া :
a) কপার সালফেটের সঙ্গে বিক্রিয়া - নীল বর্ণের কপার সালফেটের জলীয় দ্রবণের সঙ্গে বিক্রিয়া করে কালো বর্ণের কপার সালফাইড অধঃক্ষিপ্ত করে ।
CuSO₄ + H₂S ⟶ CuS(কালো ) + H₂SO₄
b) লেড নাইট্রেটের সঙ্গে বিক্রিয়া - লেড নাইট্রেটের বর্ণহীন জলীয় দ্রবণে H₂S চালনা করলে কালো বর্ণের লেড সালফাইড অধঃক্ষিপ্ত হয় ।
Pb(NO₃)₂ + H₂S ⟶ PbS(কালো ) +2 HNO₃
c) সিলভার নাইট্রেট দ্রবনের সঙ্গে বিক্রিয়া - সিলভার নাইট্রেট দ্রবনে H₂S চালনা করলে কালো বর্ণের সিলভার সালফাইড উৎপন্ন হয় ।
2AgNO₃ + H₂S ⟶ Ag₂S(কালো ) + 2 HNO₃
H₂S এর বিষক্রিয়া :
H₂S বিষাক্ত গ্যাস ।এর সংস্পর্শে চোখ জ্বালা ,মাথাধরা ও বমিভাব ইত্যাদি উপসর্গ দেখা যায় ।পরিবেশে H₂S 100 ppm অপেক্ষা বেশি থাকলে পক্ষাঘাত এমনকি মৃত্যু পর্যন্ত হতে পারে ।
প্রতিকার - ক্লোরিনের লঘু জলীয় দ্রবণ H₂S এর বিষক্রিয়ার প্রতিষেধক হিসাবে ব্যবহৃত হয় ।
নাইট্রোজেন
সংকেত - N₂ আনবিক ওজন - 28
বায়ু মণ্ডলের প্রায় 79% নাইট্রোজেন ।
নাইট্রোজেনের পরীক্ষাগার প্রস্তুতি :
প্রয়োজনীয় রাসায়নিক দ্রব্য :
সোডিয়াম নাইট্রাইট (NaNO₂) ও এমোনিয়াম ক্লোরাইড ( NH₄Cl) ।
সোডিয়াম নাইট্রাইট ও আমমোনিয়ামক্লোরাইড কে 1 :1 মোল অনুপাতে মিশিয়ে ধীরে ধীরে গরম করলে নাইট্রোজেন উৎপন্ন হয় ।বিক্রিয়াটি দুটি ধাপে সংঘটিত হয় ।
1) NaNO₂ + NH₄Cl ⟶ NaCl + NH₄NO₂
2)NH₄NO₂⟶ N₂ + 2H₂O
NH₄NO₂ কে সরাসরি উতপ্ত করা হয় না , কারণ সরাসরি গরম করলে প্রচন্ড তাপ উৎপন্ন হয় ফলে বিস্ফোরণ হওয়ার সম্ভাবনা থাকে ।তাই বিক্রিয়াটি দুটি ধাপে সম্পন্ন করা হয় ।
নাইট্রোজেনের ধৰ্ম :
ভৌতধর্ম - নাইট্রোজেন বর্ণহীন ,গন্ধহীন গ্যাস । এটি বিষাক্ত নয় কিন্তূ শ্বাস কার্য্যে সাহায্য করে না ।
রাসায়নিক ধৰ্ম :
নাইট্রোজেন অণুতে দুটি নাইট্রোজেন পরমাণু পরস্পর ত্রিবন্ধন দ্বারা যুক্ত থাকে ; বন্ধনটি খুব দৃঢ় হওয়ায় অণুটিকে বিয়োজিত করতে প্রচুর শক্তির প্রয়োজন ।তাই সাধারণ উষ্নতায় নাইট্রোজেন একটি নিষ্ক্রিয় প্রকৃতির গ্যাস ।
ম্যাগনিসিয়ামের সঙ্গে বিক্রিয়া -উচ্চ উস্নতায় নাইট্রোজেন ম্যাগনেসিয়াম ধাতুর সঙ্গে যুক্ত হয়ে ম্যাগনেসিয়াম নাইট্রাইড গঠন করে ।
3Mg + N₂ ⟶ Mg₃N₂
ম্যাগনেশিয়াম নাইট্রাইডের সঙ্গে গরম জলের বিক্রিয়াতে অ্যামোনিয়া তৈরি হয় ।
Mg₃N₂ +6 H₂O ⟶ 3Mg(OH)₂ + 2NH₃
অক্সিজেনের সঙ্গে বিক্রিয়া:
3000⁰C তাপমাত্রায় বিদ্যুৎ ফুলিঙ্গের সাহায্যে নাইট্রোজেন ও অক্সিজেন সরাসরি যুক্ত হয়ে নাইট্রিক অক্সাইড গঠন করে ।
N₂ + O₂ ⟶ 2NO
হাইড্রোজেনের সঙ্গে বিক্রিয়া -
200 বায়ুমণ্ডলীয় চাপে 450⁰C তাপমাত্রায় আয়রণ চূর্ণ অনুঘটক এবং K₂O ও Al₂O₃ উদ্দীপকের উপস্থিতিতে নাইট্রোজেন ও হাইড্রোজেন যুক্ত হয়ে অ্যামোনিয়া গঠন করে ।
N₂ + 3H₂ ⇌2 NH₃ +তাপ
ক্যালসিয়াম কার্বাইডের সঙ্গে বিক্রিয়া :
1100⁰C উষ্নতায় ক্যালসিয়াম কার্বাইডের সঙ্গে বিক্রিয়া করে ক্যালসিয়াম সায়ানামাইড ও কার্বন উৎপন্ন করে ।
ক্যালসিয়াম সায়ানামাইড(CaCN₂) ও কার্বন এর মিশ্রণকে নাইট্রোলিম বলে । ইহা নাইট্রোজেন ঘটিত সার হিসাবে ব্যবহৃত হয় ।
CaC₂ + N₂ ⟶ CaCN₂ + C
নাইট্রোজেনের আবদ্ধিকরণ :
কৃত্রিম বা প্রাকৃতিক উপায়ে বায়ুমন্ডলের নাইট্রোজেনকে নাইট্রোজেন ঘটিত যৌগে পরিণত করার প্রক্রিয়াকে নাইট্রোজেনের আবদ্ধিকরণ বলে । আকাশে মেঘের মধ্যে যখন বিদ্যুৎ ক্ষরণ হয় তখন বায়ুমন্ডলের নাইট্রোজেন ও অক্সিজেন যুক্ত হয়ে নাইট্রিক অক্সাইড (NO) গঠন করে । এই নাইট্রিক অক্সাইড বায়ুর অক্সিজেন দ্বারা পুনরায় জারিত হয়ে নাইট্রোজেন ডাই অক্সাইড(NO₂) গঠন করে ।বৃষ্টির জলে নাইট্রোজেন ডাই অক্সাইড দ্রবীভূত হয়ে নাইট্রিক এসিড (HNO₃) ও নাইট্রাস এসিডে(HNO₂) পরিণত হয় এবং বৃষ্টির জলের সঙ্গে মাটিতে পড়ে যায় ।নাইট্রাস এসিড অস্থায়ী ।নাইট্রিক এসিড মাটির ক্ষার বা ক্ষারকের সঙ্গে বিক্রিয়া করে দ্রাব্য নাইট্রেট লবন গঠন করে এবং মাটিতে মিশে যায় ।
হাইড্রোক্লোরিক এসিডের শিল্প প্রস্তুতি :
আধুনিক সংশ্লেষণ পদ্ধতি - হাইড্রোজেন ও ক্লোরিন গ্যাসের সম আয়তনিক মিশ্রণকে একটি সিলিকা নির্মিত প্রকোষ্টে জ্বালানো হয় ।এতে H₂ ও Cl₂ গ্যাস যুক্ত হয়ে HCl গ্যাস উৎপন্ন হয় ।
H₂ + Cl₂ ⟶ 2HCl
উৎপন্ন HCl গ্যাসকে হিম কক্ষের মধ্যে পাঠিয়ে শীতল করা হয় । শীতল HCl গ্যাসকে জলে শোষিত করে গাঢ় হাইড্রোক্লোরিক এসিডের সম্পৃক্ত দ্রবণ প্রস্তুত করা হয় ।ভর হিসাবে এতে 36% HCl গ্যাস দ্রবীভূত থাকে ।
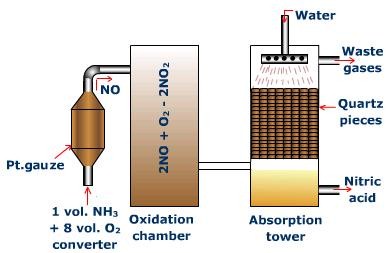
অসওয়াল্ড পদ্ধতিতে নাইট্রিক এসিডের শিল্প প্রস্তুতি :
এই পদ্ধতিতে অ্যামোনিয়া কে জারিত করে নাইট্রিক অ্যাসিড প্রস্তুত করা হয় ।শুস্ক ও বিশুদ্ধ ধুলিকণামুক্ত অ্যামোনিয়া ও বায়ুর মিশ্রণকে 5-7 বায়ুমণ্ডলীয় চাপে ,700 -800⁰C উষ্নতায় উতপ্ত প্ল্যাটিনাম তারজালি এর ওপর দিয়ে প্রবাহিত করলে অ্যামোনিয়া জারিত হয়ে নাইট্রিক অক্সাইড উৎপন্ন করে ।
1) 4 NH₃ + 5O₂ ⟶4 NO + 6H₂O
উৎপন্ন নাইট্রিক অক্সাইড কে দ্রুত শীতল করে বায়ুর অক্সিজেন দ্বারা জরিত করে নাইট্রোজেন ডাই অক্সাইড এ রূপান্তরিত করা হয় ।
2) 2NO + O₂ ⟶ 2NO₂
এই ভাবে উৎপন্ন NO₂ কে জল দ্বারা শোষিত করে নাইট্রিক অ্যাসিড উৎপন্ন করা হয় ও NO গ্যাস নির্গত হয় ।
নির্গত NO গ্যাসকে পুনরায় অক্সিজেন দ্বারা জারিত করে নাইট্রিক অ্যাসিড উৎপাদনে ব্যবহার করা হয় ।
3) 3NO₂ + H₂O ⟶ 2HNO₃ + NO
স্পর্শ পদ্ধতি দ্বারা সালফিউ রিক অ্যাসিড(H₂SO₄) প্রস্তুতি :
আয়রন পাইরাইটিস (FeS₂) বা সালফারকে অতিরিক্ত বায়ুতে পুড়িয়ে সালফার ডাই অক্সাইড(SO₂) গ্যাস উতপন্ন করা |হয় ।SO₂ ও বায়ুর মিশ্রণকে বিশুদ্ধ ও শুস্ক করে 450⁰C উস্নতায় 1 -1.5 বায়ুমণ্ডলীয় চাপে প্ল্যাটিনাম অ্যাসবেসটস বা ভ্যানাডিয়াম পেন্টঅক্সাইড (V₂O₅) অনুঘটকের চালনা করলে SO₂ গ্যাস বায়ুর অক্সিজেন দ্বারা জারিত হয়ে সালফার ট্রাই অক্সাইড(SO₃ ) উৎপন্ন করে ।বিক্রিয়াটি উভমুখী ও তাপমোচি ।
S + O₂ ⟶ SO₂ ;
2SO₂ + O₂ ⟶ 2SO₃ + তাপ
SO₃ কে ঠান্ডা করে কোক ভর্তি শোষক স্থম্ভে 98% গাঢ় H₂SO₄ দ্বারা শোষিত হয়ে ওলিয়াম উৎপন্ন হয় ।
H₂SO₄ + SO₃ ⟶ H₂S₂O₇ (ওলিয়াম )
ওলিয়ামের সঙ্গে পরিমান মত পাতিত জল মিশিয়ে 98% গাঢ় H₂SO₄ অ্যাসিড প্রস্তুত করা হয় ।
H₂S₂O₇ + H₂O ⟶2 H₂SO₄

বহু বিকল্প ভিত্তিক প্রশ্ন (MCQ): https://forms.gle/uNiyCug3YcsxiS1KA
1) কোনটি দ্বারা অ্যামোনিয়া কে শুস্ক করা হয় ?
A) গাঢ় H₂SO₄ B) অনার্দ্র CaCl₂ C) CaO D) P₂O₅
2) কোণ গ্যাসের সংস্পর্শে নেসলের দ্রবণ তামাটে হয় ?
A) N₂ B) HCl C) NH₃ D) H₂S
3) ক্ষারীয় সোডিয়াম নিটরপ্রুসাইড দ্রবণে H₂S চালনা করলে দ্রবণ টির বর্ণ হয়
A) লাল B) নীল C) সবুজ D) বেগুনী
4) স্পর্শ পদ্ধতিতে H₂SO₄ এর প্রস্তুতিতে যে অনুঘটকটি ব্যবহার করা হয় তা হল
A) MnO₂ B) V₂O₅ C) আয়রণ চূর্ণ D) কোনোটাই নয়
5) ফেরিক হাইড্রো অক্সিডের Fe(OH)₃ বর্ণ হল
A) হলুদ B) সাদা C) কালো D) বাদামী
6) অস ওয়াল্ড পদ্ধতিতে HNO₃ প্রস্তুত করতে অনুঘটক হিসাবে ব্যবহৃত হয়
A) 10% রেডিয়াম যুক্ত প্ল্যাটিনাম তারজালি B) প্ল্যাটিনাম চূর্ণ C) ভ্যানাডিয়াম পেন্ট অক্সাইড D) লৌহ চূর্ণ
7) নাইট্রোজেন আবদ্ধ করণের প্রথম ধাপে বিদুৎপাতের ফলে নীচের কোনটি উৎপন্ন হয় ?
A) NO B) NO₂ C) N₂O₅ D) HNO₃
8) লাল লিটমাসের দ্রবনের বর্ণ নীল করে
A) H₂S B) NH₃ C) N₂ D) HCl
9) লা ব্ল্যাঙ্ক পদ্ধতিতে প্রস্তুত হয়
A) HCl B) H₂SO₄ C) HNO₃ D) ইউরিয়া
10) নীচের কোন গ্যাসটি কিপ যন্ত্রে প্রস্তুত করা হয় ?
A) N₂ B) H₂S C) HCl D) NH₃
11) কপার সালফেটের জলীয় দ্রবণে অতিরিক্ত পরিমাণ জলীয় অ্যামোনিয়া যোগ করলে দ্রবনের রং কি হবে ?
A) হলুদ B) সবুজ C) গাঢ় নীল D) বাদামী


কোন মন্তব্য নেই:
একটি মন্তব্য পোস্ট করুন