পর্যায় সারণি ( Periodic Table):
মেন্ডেলিভের পর্যায় সূত্র :
বিভিন্ন মৌলের ভৌত ও রাসায়নিক ধর্মগুলি ওদের পারমাণবিক গুরুত্ত্ব বাড়ার সঙ্গে সঙ্গে পর্যয়ক্রমে পুনরাবৃত্ত হয় ।
মেন্ডেলিভের পর্যায় সারণি :
মেন্ডেলিভের পর্যায় সূত্র অনুসারে মৌলগুলিকে বিভিন্ন অনুভূমিক ও উলম্ব সারিতে সাজিয়ে যে তালিকা করা হয়েছে তাকে মেন্ডেলিভের পর্যায় সারণি বলে । এই সারণিতে সাতটি পর্যায় ও আটটি শ্রেণী আছে । নিষ্ক্রিয় মৌলগুলি মেন্ডেলিভের সময় আবিষকৃত না হওয়ায় ওদের কোনো অবস্থান ছিল না । পরে নিষ্ক্রিয় মৌল গুলিকে শূন্য শ্রেণীতে রাখা হয়েছে । একই শ্রেণীর মৌলগুলির ধৰ্ম ও যোজ্যতা একই হয় ।

মৌলগুলির অবস্থানের কয়েকটি ক্ষেত্রে পর্যায়সূত্র ঠিকমতো মানা হয় নাই ।যেমন অর্গনকে (Ar 39.9) পটাসিয়ামের (K 39.1) আগে , এবং কোবল্টকে (Co 58.94) নিকেলের (Ni 58.69) আগে রাখা হয়েছে । এক্ষেত্রে পারমাণবিক গুরুত্ত্ব অপেক্ষা ভৌত রাসায়নিক ধর্মের পুনৰাবৃত্তিকে প্রাধান্য দেওয়া হয়েছে ।
আধুনিক পর্যায় সূত্র (সংশোধিত পর্যায় সূত্র ):
বিভিন্ন মৌলের ভৌত ও রাসায়নিক ধর্মগুলি ওদের পারমানবিক সংখ্যা বাড়ার সঙ্গে সঙ্গে পর্যয়ক্রমে পুনরাবৃত্ত হয় আধুনিক পর্যায় অনুসারে পর্যায় সারণির বর্ণনা :
পর্যায় সারণির অনুভূমিক সারিগুলিকে পর্যায় বলে । এই সারণিতে মোট 7 টি পর্যায় (Period) আছে ।
1) প্রথম পর্যায় : এই পর্যায়ে দুটি মৌল আছে । হাইড্রোজেন (He ) এবং হিলিয়াম (He) |
2) দ্বিতীয় পর্যায় : এখানে 8 টি মৌল আছে ।( Li,Be,B,C,N,O,F Ne)
3) তৃতীয় পর্যায় : এখানেও 8 টি মৌল আছে । সোডিয়াম (Na ) থেকে আর্গন (Ar) |
4) চতুর্থ পর্যায় : এই পর্যায়ে মৌলের সংখ্যা 18 টি । পটাসিয়াম (K ) থেকে ক্রিপ্টন (Kr) |
5) পঞ্চম পর্যায় : এই পর্যায়েও মৌল আছে 18 টি । রুবিডিয়াম (Rb) থেকে জেনন (Xe) |
6) ষষ্ট পর্যায় : এই পর্যায়ে মৌলের সংখ্যা 32 টি । সিজিয়াম (Cs) থেকে রেডন (Rn)
7) সপ্তম পর্যায় : এটি অসম্পূর্ণ পর্যায় ।
প্রথম পর্যায়কে অতি হস্র পর্যায় বলে , কারণ এই পর্যায়ে মাত্র দুটি মৌল আছে । দ্বিতীয় ও তৃতীয় পর্যায়কে হস্র পর্যায় বলে কারণ এখানে 8 টি মৌল বর্তমান । চতুর্থ ও পঞ্চম পর্যায়কে দীর্ঘ পর্যায় বলে । এই পর্যায় গুলিতে মৌল আছে 18 টি করে । ষষ্ট পর্যায়কে অতি দীর্ঘ পর্যায় বলে । এই পর্যায়ে মৌল আছে ৩২ টি ।
দ্বিতীয় ও তৃতীয় পর্যায়ে কোনো নিৰ্দিষ্ট মৌল থেকে আরম্ভ করে অষ্টম মৌলে ধর্মের পুনরাবৃত্তি ঘটে । চতুর্থ ও পঞ্চম পর্যায়ে ধর্মের পুনরাবৃত্তি ঘটে প্রতি অষ্টাদশ মৌলে ।
শ্রেণির বর্ণনা :
পর্যায় সারণির উলম্ব সারিগুলিকে শ্রেণি বলে । আধুনিক পর্যায় সারণিতে 9 টি শ্রেণি আছে । I থেকে VIII এবং 0 শ্রেণি । শূন্য শ্রেণিতে নিষ্ক্রিয় মৌল গুলি বর্তমান ।
আধুনিক দীর্ঘ পর্যায় সারণি (Modern long form of periodic table) :
1926 সালে বিজ্ঞানী বোর পরমাণুর ইলেকট্রন বিন্যাসের উপর নির্ভর একটি বড় আকারের পর্যায় সারণি তৈরি করেন । এই সারানিকে দীর্ঘ পর্যায় সারণি বা বোরের পর্যায় সারণি নামে পরিচিত ।
পর্যায়ের(Periods) বিবরণ : দীর্ঘ পর্যায় সারণিতে পর্যায় সংখ্যা 7 টি । 1,2,3,4,5,6,7 সংখ্যা দ্বারা লেখা হয় । এক একটি পর্যায় সংখ্যা মৌলের পরমাণুর কক্ষপথ নিৰ্দেশ করে । কোনো নিৰ্দিষ্ট পর্যায়ে মৌলগুলির ইলেকট্রন বিন্যাস বিভিন্ন হওয়ায় ওদের রাসায়নিক ধৰ্ম ভিন্ন হয় ।

শ্রেণির বর্ণনা ( Group description) :
দীর্ঘ পর্যায় সারণিতে 18 টি শ্রেণিতে মৌল গুলিকে রাখা হয়েছে । 1 থেকে 18 সংখ্যা দ্বারা প্রকাশিত । একটি নিৰ্দিষ্ট শ্রেণিতে মৌলগুলির সর্ব বহিঃস্থ কক্ষে সমান সংখ্যক ইলেকট্রন থাকায় ওই শ্রেণির সব মৌলের যোজ্যতা ও রাসায়নিক ধৰ্ম একই হয় ।

উপরের টেবিল থেকে বোঝা যায় যে একই শ্রেণিতে অবস্থিত মৌলগুলির সর্ব বহিঃস্থ কক্ষে সমান সংখ্যাক ইলেকট্রন আছে । যেমন 3 নং শ্রেণিতে B ও Al এর বাহিরের কক্ষে 3 টি ইলেকট্রন আছে ।
পর্যায় সারণিতে হাইড্রোজেনের অবস্থান :
হাইড্রোজেনের অবস্থান বিতর্কমূলক । কারণ হাইড্রোজেনের সঙ্গে IA(1) এবং VIIB(17) শ্রেণির মৌলের ধর্মের সাদৃশ্য আছে । সুতরাং হাইড্রোজেনকে উভয় শ্রেণিতে স্থান দেওয়া যেতে পারে ।
ক্ষার ধাতুর সঙ্গে সাদৃশ্য :
ক্ষারধাতু ( Li,Na,K ইত্যাদি ) গুলির মতো হাইড্রোজেনের যোজ্যতা 1 হয় । হাইড্রোজেন ক্ষার ধাতুর মতো তড়িৎ ধনাত্মক মৌল । ক্ষার ধাতুর মতো হাইড্রোজেন ধনাত্মক আয়ন (H ⁺) গঠন করে । ইহা ক্ষার ধাতুর মতো অক্সাইড ( H₂O ) উৎপন্ন করে ।
ক্ষার ধাতুর মতো হাইড্রোজেন বিজারক পদার্থ । সুতরাং হাইড্রোজেনকে IA শ্রেণিতে রাখা যায় ।
হ্যালোজেন মৌলগুলির সঙ্গে সাদৃশ্য :
VIIB শ্রেণির হ্যালোজেন মৌলগুলির মতো হাইড্রোজেনের অনু দ্বিপরমাণুক অর্থাৎ একটি অণুতে দুটি পরমাণু থাকে । ফ্লুরিন ও ক্লোরিনের মতো হাইড্রোজেনও গ্যাস এবং অধাতু । হ্যালোজেন ( VIIB এর মৌল ) মৌল গুলি ধাতুর সঙ্গে যুক্ত হলে হ্যালাইড উৎপন্ন করে । একই রকম ভাবে হাইড্রোজেনও ধাতুর সঙ্গে যুক্ত হয়ে হাইড্রাইড ( NaH,CaH₂) গঠন করে । সুতরাং হাইড্রোজেনকে VIIB শ্রেনিতে স্থান দেওয়া যায় ।
ক্ষার ধাতু Alkali metal):
IA বা 1 নং শ্রেণির মৌলগুলিকে ক্ষার ধাতু বলে । মৌলগুলি হলো - লিথিয়াম (Li),সোডিয়াম (Na ), পটাসিয়াম (Ka ),রুবুবিয়াম (Rb ), সিজিয়াম (Cs ) এবং ফ্রানসিয়াম (Fr ) । এই ধাতুগুলি তীব্র তড়িৎ ধনাত্বকধর্মী , এদের অক্সাইড তীব্র ক্ষারীয় । যোজ্যতা এক হয় ।

ক্ষারীয় মৃত্তিকা ধাতু (Alkaline earth metals):
পর্যায় সারণির 2 নং পর্যায় (IIA )এ অবস্থিত মৌলগুলিকে ক্ষারীয় মৃত্তিকা মৌল বলে ।এই পরমাণু গুলির সর্ব বহিঃস্থ কক্ষে 2 টি ইলেকট্রন আছে । ধাতুগুলি তড়িৎ ধনাত্মক ধর্মী । এদের অক্সাইড ক্ষারীয় ।

রেডিয়াম তেজস্ক্রিয় মৌল ।
হ্যালোজেন :
পর্যায় সারণির 17 নং শ্রেণি বা VIIB শ্রেণিতে অবস্থিত মৌল গুলিকে হ্যালোজেন বলে । মৌলগুলির সর্ব বহিঃস্থ কক্ষে 7 ইলেকট্রন থাকে । যোজ্যতা(হাইড্রোজেন ভিত্তিক ) 1 হয় । এগুলি জারক পদার্থ ।

মৌল গুলির নাম হল - ফ্লোরিন(F) ,ক্লোরিন (Cl) ,ব্রোমিন(Br),আয়োডিন(I) ও এস্টেটিন (astatine ,At )
নিষ্ক্রিয় মৌল :
18 নং বা শূন্য শ্রেণির মৌল গুলিকে নিষ্ক্রিয় মৌল বলে ।এরা হল -He, Ne,Ar,Kr,Xe, এবং Rn | এই পরমাণু গুলির বাহিরের কক্ষ পূর্ণ থাকে । হেলিয়ামের বাহিরের কক্ষে 2 টি এবং অন্যান্য মৌলগুলির বাহিরের কক্ষে 8 টি ইলেকট্রন থাকে । এগুলি রাসায়নিক ভাবে সম্পূর্ণ নিষ্ক্রিয় । এদের বিরল গ্যাসও বলা হয় কারণ প্রকৃতিতে খুব কম পরিমানে পাওয়া যায় ।

সন্ধিগত মৌল ( Transitional element) :
একাধিক যোজ্যতা সহ কয়েকটি বিশেষ ধর্মের অধিকারী মৌলগুলিকে সন্ধিগত মৌল বলে । চতুর্থ পর্যায়ে Sc(21) থেকে Zn(30) ,পঞ্চম পর্যয়ে Yttrium Y (৩৯) থেকে Cd(48) এবং ষষ্ট পর্যায়ে La(57),Hf(72) থেকে Hg (80) পর্যন্ত মৌল গুলিকে সন্ধিগত মৌল বলে ।
এদের একাধিক যোজ্যতা আছে জটিল যৌগ গঠন করে ।
মৌলের ধর্মের পর্যাবৃত্ততা (Periodicity property of elements) :
পারমাণবিক ব্যাসার্ধ (Atomic Radius):
কোনো একটি পর্যয়ে বাম থেকে ডান দিকে অগ্রসর হলে পারমাণবিক ব্যাসার্ধ হ্রাস পায় । 18 নং শ্রেণির নিষ্ক্রিয় মৌলের ব্যাসার্ধ আবার বৃদ্ধি পায় ।

যে কোনো শ্রেণিতে ওপর থেকে নিচে নামলে পারমাণবিক ব্যাসার্ধ বা আকার ক্রমশ বড় হয় ।

আয়োনীভবন বিভব (Ionisation energy or ionization potential):
যখন কোনো বিচ্ছিন্ন পরমাণুর সর্ব বহিঃস্থ কক্ষ থেকে একটি ইলেকট্রনকে সম্পূর্ণভাবে বিচ্ছিন্ন করতে অর্থাৎ পারমাণুটিকে একক ধনাত্মক আয়ন এ পরিণত করতে যে নূন্যতম শক্তির প্রয়োজন হয় তাকে ওই পরমাণুর আয়োনীভবন বিভব বলে ।
পর্যায় সারণিতে কোনো পর্যায়ে পরমাণু ক্রমাঙ্ক বাড়ার সঙ্গে সঙ্গে আয়োনীভবন বিভব বাড়ে । একই শ্রেণিতে ওপর থেকে নিচে আয়োনীভবন বিভব হ্রাস পায় ।

তড়িৎ ঋণাত্মকতা (Elctronegativity) :
সম যোজি বন্ধনে আবদ্ধ কোনো মৌলের পরমাণুর ইলেকট্রন জোড়কে নিজের দিকে আকর্ষণ করার ক্ষমতাকে ওই মৌলের তড়িৎ ঋণাত্মকতা বলে ।

পর্যায় বরাবর বাম থেকে ডানদিকে তড়িৎ ঋণাত্মকতা বাড়ে । শ্রেণি বরাবর উপর থেকে নিচে তড়িৎ ঋণাত্মকতা কমে ।
জারণ ও বিজারণ ধৰ্ম (Oxidizing and Reducing power):
কোনো পরমাণু ইলেকট্রন গ্রহণের ক্ষমতা যত বেশি সেই পরমাণু তত বেশি শক্তিশালী জারক পদার্থ । আবার যে পরমাণুর ইলেক্ট্রন ত্যাগের প্রবণতা যত বেশি সেই পরমাণু তত বেশি শক্তিশালী বিজারক পদার্থ ।

মেন্ডেলিভের পর্যায় সূত্র :
বিভিন্ন মৌলের ভৌত ও রাসায়নিক ধর্মগুলি ওদের পারমাণবিক গুরুত্ত্ব বাড়ার সঙ্গে সঙ্গে পর্যয়ক্রমে পুনরাবৃত্ত হয় ।
মেন্ডেলিভের পর্যায় সারণি :
মেন্ডেলিভের পর্যায় সূত্র অনুসারে মৌলগুলিকে বিভিন্ন অনুভূমিক ও উলম্ব সারিতে সাজিয়ে যে তালিকা করা হয়েছে তাকে মেন্ডেলিভের পর্যায় সারণি বলে । এই সারণিতে সাতটি পর্যায় ও আটটি শ্রেণী আছে । নিষ্ক্রিয় মৌলগুলি মেন্ডেলিভের সময় আবিষকৃত না হওয়ায় ওদের কোনো অবস্থান ছিল না । পরে নিষ্ক্রিয় মৌল গুলিকে শূন্য শ্রেণীতে রাখা হয়েছে । একই শ্রেণীর মৌলগুলির ধৰ্ম ও যোজ্যতা একই হয় ।

মৌলগুলির অবস্থানের কয়েকটি ক্ষেত্রে পর্যায়সূত্র ঠিকমতো মানা হয় নাই ।যেমন অর্গনকে (Ar 39.9) পটাসিয়ামের (K 39.1) আগে , এবং কোবল্টকে (Co 58.94) নিকেলের (Ni 58.69) আগে রাখা হয়েছে । এক্ষেত্রে পারমাণবিক গুরুত্ত্ব অপেক্ষা ভৌত রাসায়নিক ধর্মের পুনৰাবৃত্তিকে প্রাধান্য দেওয়া হয়েছে ।
আধুনিক পর্যায় সূত্র (সংশোধিত পর্যায় সূত্র ):
বিভিন্ন মৌলের ভৌত ও রাসায়নিক ধর্মগুলি ওদের পারমানবিক সংখ্যা বাড়ার সঙ্গে সঙ্গে পর্যয়ক্রমে পুনরাবৃত্ত হয় আধুনিক পর্যায় অনুসারে পর্যায় সারণির বর্ণনা :
পর্যায় সারণির অনুভূমিক সারিগুলিকে পর্যায় বলে । এই সারণিতে মোট 7 টি পর্যায় (Period) আছে ।
1) প্রথম পর্যায় : এই পর্যায়ে দুটি মৌল আছে । হাইড্রোজেন (He ) এবং হিলিয়াম (He) |
2) দ্বিতীয় পর্যায় : এখানে 8 টি মৌল আছে ।( Li,Be,B,C,N,O,F Ne)
3) তৃতীয় পর্যায় : এখানেও 8 টি মৌল আছে । সোডিয়াম (Na ) থেকে আর্গন (Ar) |
4) চতুর্থ পর্যায় : এই পর্যায়ে মৌলের সংখ্যা 18 টি । পটাসিয়াম (K ) থেকে ক্রিপ্টন (Kr) |
5) পঞ্চম পর্যায় : এই পর্যায়েও মৌল আছে 18 টি । রুবিডিয়াম (Rb) থেকে জেনন (Xe) |
6) ষষ্ট পর্যায় : এই পর্যায়ে মৌলের সংখ্যা 32 টি । সিজিয়াম (Cs) থেকে রেডন (Rn)
7) সপ্তম পর্যায় : এটি অসম্পূর্ণ পর্যায় ।
প্রথম পর্যায়কে অতি হস্র পর্যায় বলে , কারণ এই পর্যায়ে মাত্র দুটি মৌল আছে । দ্বিতীয় ও তৃতীয় পর্যায়কে হস্র পর্যায় বলে কারণ এখানে 8 টি মৌল বর্তমান । চতুর্থ ও পঞ্চম পর্যায়কে দীর্ঘ পর্যায় বলে । এই পর্যায় গুলিতে মৌল আছে 18 টি করে । ষষ্ট পর্যায়কে অতি দীর্ঘ পর্যায় বলে । এই পর্যায়ে মৌল আছে ৩২ টি ।
দ্বিতীয় ও তৃতীয় পর্যায়ে কোনো নিৰ্দিষ্ট মৌল থেকে আরম্ভ করে অষ্টম মৌলে ধর্মের পুনরাবৃত্তি ঘটে । চতুর্থ ও পঞ্চম পর্যায়ে ধর্মের পুনরাবৃত্তি ঘটে প্রতি অষ্টাদশ মৌলে ।
শ্রেণির বর্ণনা :
পর্যায় সারণির উলম্ব সারিগুলিকে শ্রেণি বলে । আধুনিক পর্যায় সারণিতে 9 টি শ্রেণি আছে । I থেকে VIII এবং 0 শ্রেণি । শূন্য শ্রেণিতে নিষ্ক্রিয় মৌল গুলি বর্তমান ।
আধুনিক দীর্ঘ পর্যায় সারণি (Modern long form of periodic table) :
1926 সালে বিজ্ঞানী বোর পরমাণুর ইলেকট্রন বিন্যাসের উপর নির্ভর একটি বড় আকারের পর্যায় সারণি তৈরি করেন । এই সারানিকে দীর্ঘ পর্যায় সারণি বা বোরের পর্যায় সারণি নামে পরিচিত ।
পর্যায়ের(Periods) বিবরণ : দীর্ঘ পর্যায় সারণিতে পর্যায় সংখ্যা 7 টি । 1,2,3,4,5,6,7 সংখ্যা দ্বারা লেখা হয় । এক একটি পর্যায় সংখ্যা মৌলের পরমাণুর কক্ষপথ নিৰ্দেশ করে । কোনো নিৰ্দিষ্ট পর্যায়ে মৌলগুলির ইলেকট্রন বিন্যাস বিভিন্ন হওয়ায় ওদের রাসায়নিক ধৰ্ম ভিন্ন হয় ।

শ্রেণির বর্ণনা ( Group description) :
দীর্ঘ পর্যায় সারণিতে 18 টি শ্রেণিতে মৌল গুলিকে রাখা হয়েছে । 1 থেকে 18 সংখ্যা দ্বারা প্রকাশিত । একটি নিৰ্দিষ্ট শ্রেণিতে মৌলগুলির সর্ব বহিঃস্থ কক্ষে সমান সংখ্যক ইলেকট্রন থাকায় ওই শ্রেণির সব মৌলের যোজ্যতা ও রাসায়নিক ধৰ্ম একই হয় ।

উপরের টেবিল থেকে বোঝা যায় যে একই শ্রেণিতে অবস্থিত মৌলগুলির সর্ব বহিঃস্থ কক্ষে সমান সংখ্যাক ইলেকট্রন আছে । যেমন 3 নং শ্রেণিতে B ও Al এর বাহিরের কক্ষে 3 টি ইলেকট্রন আছে ।
পর্যায় সারণিতে হাইড্রোজেনের অবস্থান :
হাইড্রোজেনের অবস্থান বিতর্কমূলক । কারণ হাইড্রোজেনের সঙ্গে IA(1) এবং VIIB(17) শ্রেণির মৌলের ধর্মের সাদৃশ্য আছে । সুতরাং হাইড্রোজেনকে উভয় শ্রেণিতে স্থান দেওয়া যেতে পারে ।
ক্ষার ধাতুর সঙ্গে সাদৃশ্য :
ক্ষারধাতু ( Li,Na,K ইত্যাদি ) গুলির মতো হাইড্রোজেনের যোজ্যতা 1 হয় । হাইড্রোজেন ক্ষার ধাতুর মতো তড়িৎ ধনাত্মক মৌল । ক্ষার ধাতুর মতো হাইড্রোজেন ধনাত্মক আয়ন (H ⁺) গঠন করে । ইহা ক্ষার ধাতুর মতো অক্সাইড ( H₂O ) উৎপন্ন করে ।
ক্ষার ধাতুর মতো হাইড্রোজেন বিজারক পদার্থ । সুতরাং হাইড্রোজেনকে IA শ্রেণিতে রাখা যায় ।
হ্যালোজেন মৌলগুলির সঙ্গে সাদৃশ্য :
VIIB শ্রেণির হ্যালোজেন মৌলগুলির মতো হাইড্রোজেনের অনু দ্বিপরমাণুক অর্থাৎ একটি অণুতে দুটি পরমাণু থাকে । ফ্লুরিন ও ক্লোরিনের মতো হাইড্রোজেনও গ্যাস এবং অধাতু । হ্যালোজেন ( VIIB এর মৌল ) মৌল গুলি ধাতুর সঙ্গে যুক্ত হলে হ্যালাইড উৎপন্ন করে । একই রকম ভাবে হাইড্রোজেনও ধাতুর সঙ্গে যুক্ত হয়ে হাইড্রাইড ( NaH,CaH₂) গঠন করে । সুতরাং হাইড্রোজেনকে VIIB শ্রেনিতে স্থান দেওয়া যায় ।
ক্ষার ধাতু Alkali metal):
IA বা 1 নং শ্রেণির মৌলগুলিকে ক্ষার ধাতু বলে । মৌলগুলি হলো - লিথিয়াম (Li),সোডিয়াম (Na ), পটাসিয়াম (Ka ),রুবুবিয়াম (Rb ), সিজিয়াম (Cs ) এবং ফ্রানসিয়াম (Fr ) । এই ধাতুগুলি তীব্র তড়িৎ ধনাত্বকধর্মী , এদের অক্সাইড তীব্র ক্ষারীয় । যোজ্যতা এক হয় ।
ক্ষারীয় মৃত্তিকা ধাতু (Alkaline earth metals):
পর্যায় সারণির 2 নং পর্যায় (IIA )এ অবস্থিত মৌলগুলিকে ক্ষারীয় মৃত্তিকা মৌল বলে ।এই পরমাণু গুলির সর্ব বহিঃস্থ কক্ষে 2 টি ইলেকট্রন আছে । ধাতুগুলি তড়িৎ ধনাত্মক ধর্মী । এদের অক্সাইড ক্ষারীয় ।
রেডিয়াম তেজস্ক্রিয় মৌল ।
হ্যালোজেন :
পর্যায় সারণির 17 নং শ্রেণি বা VIIB শ্রেণিতে অবস্থিত মৌল গুলিকে হ্যালোজেন বলে । মৌলগুলির সর্ব বহিঃস্থ কক্ষে 7 ইলেকট্রন থাকে । যোজ্যতা(হাইড্রোজেন ভিত্তিক ) 1 হয় । এগুলি জারক পদার্থ ।
মৌল গুলির নাম হল - ফ্লোরিন(F) ,ক্লোরিন (Cl) ,ব্রোমিন(Br),আয়োডিন(I) ও এস্টেটিন (astatine ,At )
নিষ্ক্রিয় মৌল :
18 নং বা শূন্য শ্রেণির মৌল গুলিকে নিষ্ক্রিয় মৌল বলে ।এরা হল -He, Ne,Ar,Kr,Xe, এবং Rn | এই পরমাণু গুলির বাহিরের কক্ষ পূর্ণ থাকে । হেলিয়ামের বাহিরের কক্ষে 2 টি এবং অন্যান্য মৌলগুলির বাহিরের কক্ষে 8 টি ইলেকট্রন থাকে । এগুলি রাসায়নিক ভাবে সম্পূর্ণ নিষ্ক্রিয় । এদের বিরল গ্যাসও বলা হয় কারণ প্রকৃতিতে খুব কম পরিমানে পাওয়া যায় ।
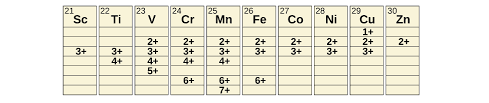
সন্ধিগত মৌল ( Transitional element) :
একাধিক যোজ্যতা সহ কয়েকটি বিশেষ ধর্মের অধিকারী মৌলগুলিকে সন্ধিগত মৌল বলে । চতুর্থ পর্যায়ে Sc(21) থেকে Zn(30) ,পঞ্চম পর্যয়ে Yttrium Y (৩৯) থেকে Cd(48) এবং ষষ্ট পর্যায়ে La(57),Hf(72) থেকে Hg (80) পর্যন্ত মৌল গুলিকে সন্ধিগত মৌল বলে ।
এদের একাধিক যোজ্যতা আছে জটিল যৌগ গঠন করে ।
মৌলের ধর্মের পর্যাবৃত্ততা (Periodicity property of elements) :
পারমাণবিক ব্যাসার্ধ (Atomic Radius):
কোনো একটি পর্যয়ে বাম থেকে ডান দিকে অগ্রসর হলে পারমাণবিক ব্যাসার্ধ হ্রাস পায় । 18 নং শ্রেণির নিষ্ক্রিয় মৌলের ব্যাসার্ধ আবার বৃদ্ধি পায় ।

যে কোনো শ্রেণিতে ওপর থেকে নিচে নামলে পারমাণবিক ব্যাসার্ধ বা আকার ক্রমশ বড় হয় ।

আয়োনীভবন বিভব (Ionisation energy or ionization potential):
যখন কোনো বিচ্ছিন্ন পরমাণুর সর্ব বহিঃস্থ কক্ষ থেকে একটি ইলেকট্রনকে সম্পূর্ণভাবে বিচ্ছিন্ন করতে অর্থাৎ পারমাণুটিকে একক ধনাত্মক আয়ন এ পরিণত করতে যে নূন্যতম শক্তির প্রয়োজন হয় তাকে ওই পরমাণুর আয়োনীভবন বিভব বলে ।
পর্যায় সারণিতে কোনো পর্যায়ে পরমাণু ক্রমাঙ্ক বাড়ার সঙ্গে সঙ্গে আয়োনীভবন বিভব বাড়ে । একই শ্রেণিতে ওপর থেকে নিচে আয়োনীভবন বিভব হ্রাস পায় ।

তড়িৎ ঋণাত্মকতা (Elctronegativity) :
সম যোজি বন্ধনে আবদ্ধ কোনো মৌলের পরমাণুর ইলেকট্রন জোড়কে নিজের দিকে আকর্ষণ করার ক্ষমতাকে ওই মৌলের তড়িৎ ঋণাত্মকতা বলে ।

পর্যায় বরাবর বাম থেকে ডানদিকে তড়িৎ ঋণাত্মকতা বাড়ে । শ্রেণি বরাবর উপর থেকে নিচে তড়িৎ ঋণাত্মকতা কমে ।
জারণ ও বিজারণ ধৰ্ম (Oxidizing and Reducing power):
কোনো পরমাণু ইলেকট্রন গ্রহণের ক্ষমতা যত বেশি সেই পরমাণু তত বেশি শক্তিশালী জারক পদার্থ । আবার যে পরমাণুর ইলেক্ট্রন ত্যাগের প্রবণতা যত বেশি সেই পরমাণু তত বেশি শক্তিশালী বিজারক পদার্থ ।
পর্যায় বরাবর বামদিক থেকে ডানটিকে জারণ ক্ষমতা বাড়ে । শ্রেণি বরাবর উপর থেকে নিচে জারণ ক্ষমতা কমে । অপরপক্ষে পর্যায় বরাবর বাম থেকে ডানে বিজারণ ক্ষমতা কমে । শ্রেণি বরাবর উপর থেকে নিচে বিজারণ ক্ষমতা বাড়ে ।যেমন - দ্বিতীয় পর্যায়ে লিথিয়াম শক্তিশালী বিজারক ,ফ্লুরিন শক্তিশালী জারক পদার্থ । 2 নং পর্যায়ে বিজারণ ধর্মের ক্রম হল - Li > Be> B > C> O> F | 17 নং শ্রেণির মৌলগুলির জারণ ধর্মের ক্রম হল F>Cl>Br> I > At
বহু বিকল্প ভিত্তিক প্রশ্ন (MCQ) [ নীচের Url টি কপি করে google ব্রাউজারে পেস্ট করলে MCQ online করতে পারবে ]
https://forms.gle/9wVUvrSW8jRFLphHA
1. নীচের কোনটি ক্ষার ধাতু নয় ?
A) Na B) Rb C) Ba D) Cs
2.কোন ক্ষার ধাতুর পরমাণুর আকার সবচেয়ে বড় ?
A) Li B) Na C) Rb D) Cs
3. কোণ হ্যালোজেনটির তড়িৎ ঋণাত্মকতা সবচেয়ে কম ?
A) F B) Br C) Cl D) I
4. কোনটির জারণ ক্ষমতা সর্বাধিক ?
A) F B) Li C) N D) O
5.কোণ মৌল গুলি নোবল গ্যাস?
A) গ্রুপ 2 B) গ্রুপ 14 C) গ্রুপ 16 D) গ্রুপ 18
6. কোণ হ্যালোজেন মৌলটির পরমাণুর আকার সবচেয়ে ছোটো ?
A) Cl B) Br C) F D) I
7.কোণ মৌলটির বিজারণ ক্ষমতা সবচেয়ে কম ?
A) K B) Na C) Li D) Cs
8. পর্যায় সারণিতে মোট পর্যায় সংখ্যা
A) 7 B) 8 C) 9 D) 18
9. হ্যালোজেন মৌল গুলি কোন শ্রেণীতে অবস্থিত ?
A) শ্রেণী 1 B) শ্রেণী 17 C) শ্রেণী 16 D) শ্রেণী 12
10. মৌলের রাসায়নিক ধৰ্ম নির্ভর করে নীচের কোনটির উপর ?
A) পারমানবিক ভর B) পারমানবিক সংখ্যা C) ভর সংখ্যা D) নিউট্রণ সংখ্যা



কোন মন্তব্য নেই:
একটি মন্তব্য পোস্ট করুন