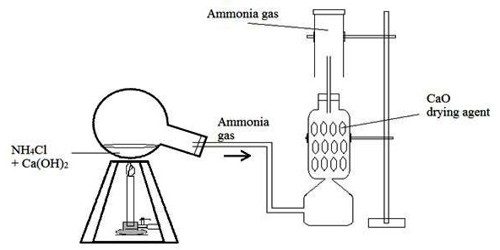
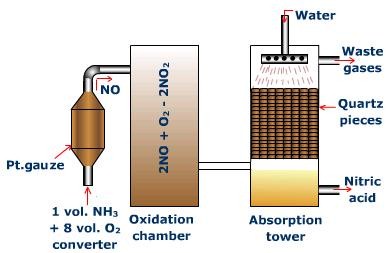
বর্তমান যুগে ধাতু ছাড়া কোনো শিল্প বা নির্মাণ কাজ সম্ভব নয় । বেশির ভাগ ধাতুগুলি বিভিন্ন যৌগ আকারে প্রকৃতিতে বর্তমান ।উপযুক্ত প্রক্রিয়ার মাধ্যমে প্রয়োজনীয় ধাতুগুলিকে এই যৌগ গুলি থেকে নিষ্কাশন করা হয় ।
কয়েকটি ধাতুর ব্যবহার :
আয়রন বা লোহার ব্যবহার - বিভিন্ন কাজে তিন প্রকারের লোহা ব্যবহৃত হয় - ঢালাই লোহা বা কাস্ট আয়রণ ,পেটা লোহা বা রট আয়রণ ও ইস্পাত বা স্টিল ।
কাস্ট আয়রণ - পাইপ ,রেলিং ,কড়াই ,ইস্ত্রি ও আলোক স্তম্ভ ইত্যাদি তৈরিতে ব্যবহার হয় ।
রট আয়রণ - পেরেক।,নাটবল্টু ,রড শেকল ও তার ইত্যাদি তৈরিতে কাজে লাগে ।
স্টিল - রেলের বগি ,ইঞ্জিন ,রেল লাইন , মোটর গাড়ি ,স্প্রিং,অস্ত্র প্রচারের যন্ত্রপাতি ,ছুরি কাঁচি ইত্যাদি তৈরিতে ব্যবহৃত হয় ।
কপার বা তামার ব্যবহার - উচ্চ তড়িৎ পারিবাহিতার জন্য বৈদ্যুতিক তার , টেলিফোনের তার ,মোটর ,ডায়নামো এবং অন্যান্য বৈদ্যুতিক যন্ত্রপাতি তৈরিতে ব্যবহৃত হয় । রান্নার বাসনপত্র ,ক্যালরিমিটার ,মুদ্রা ,অক্ষর ও মূর্তি ইত্যাদি তৈরিতে ব্যবহৃত হয় ।
জিংক বা দস্তার ব্যবহার - তড়িৎ কোষ ও নির্জল ব্যাটারি প্রস্তুতে ব্যবহৃত হয় ।লোহার জিনিসের ওপর জিংক এর প্রলেপ দিতে ,ধাতব সোনা ও রূপা নিষ্কাসনে ,পরীক্ষাগারে হাইড্রোজেন প্রস্তুতিতে এবং বিজারক রূপে কাজে লাগে । জিঙ্ক হোয়াইট নামক সাদা রঙ প্রস্তুতিতে ও ছাপার ব্লক প্রস্তুতিতে ব্যবহৃত হয় ।
এলুমিনিয়ামের ব্যবহার - হালকা ধাতু বলে বিমান বা মোটর গাড়ির কাঠামো তৈরিতে ,জানালার ফ্রেম তৈরিতে কাজে লাগে ।তাপের সুপারিবাহী বলে রান্নার বাসনপত্র ,বৈদ্যুতিক সুপারিবাহিতার কারণে বিদ্যুতিক তার তৈরিতে কাজে লাগে ।থারমিট পদ্ধতিতে রেল লাইন জোড়া লাগাতে এলুমিনিয়ামের ব্যবহার হয় ।পাতলা পাতে পরিণত করা যায় বলে প্যাকিং ফয়েল প্রস্তুতিতে এলুমিনিয়ামের ব্যবহার হয় ।
ধাতুসঙ্কর বা সংকর ধাতু :
দুই বা ততোধিক ধাতুর সমসত্ত্ব বা অসমসত্ব মিশ্রনে উৎপন্ন কঠিন দ্রাবনকে সংকর ধাতু বলে ।
ধাতুর কাঠিন্য ,নমনীয়তা বৃদ্ধি ,জলবায়ুর হাত থেকে রক্ষা করা ,জারণ ক্রিয়া হ্রাস ,তাপ ও তড়িৎ পরিবাহিতা কমানো বা বাড়ানোর জন্য সংকর ধাতু তৈরি করা হয় ।
কয়েকটি সংকর ধাতু ও তাদের ব্যবহার
| ধাতু | সংকর ধাতু | উপাদান ও সংযুক্তি | ব্যবহার |
| Fe | কলঙ্কহীন বা স্টেইনলেস স্টিল | Fe -73 %,Cr - 18%,Ni - 8%,সামান্য কার্বন থাকে | বাসনপত্র ,ছুরি ,কাঁটা চামচ ,অস্ত্রপ্রচারের যন্ত্রপাতি প্রস্তুতিতে ব্যবহৃত হয় । |
| Fe | ইনভার | Fe- 64%, Ni - 36%,সামান্য কার্বন থাকে | মিটার স্কেল ,ঘড়ির পেন্ডুলাম ,পরীক্ষাগারের যন্ত্রপাতি তৈরিতে কাজে লাগে । |
| Fe | ম্যাঙ্গানিজ স্টিল | Fe - 85%, Mn - 36%,সামান্য কার্বন থাকে | রেল লাইন ,হেলমেট ও পাথর চূর্ণ করার মেশিন প্রস্তুত করতে |
| Cu ,Zn | পিতল বা ব্রাস | Cu - 60- 80% ,Zn - 20 - 40% | বাসনপত্র ,কল ,ফুলদানি ও বিভিন্ন ভাস্কর্য্যের কাজ |
| Cu ,Zn | ব্রোঞ্জ | Cu - 80%, Zn - 2%,Sn - 18% | মুদ্রা ,মেডেল ,মূর্তি ,অলংকার ইত্যাদি |
| Cu ,Zn | জার্মান সিলভার | Cu - 50%, Zn - 20% ,Ni - 30%- | বাসনপত্র ,ফুলদানি ,অলংকার ও নানারকম সৌখিন দ্রব্য প্রস্তুতিতে |
| Cu ,Zn | গানমেটাল | Cu -87%, Sn - 10%,Zn - 2%,Pb - 1% | বন্দুক ,ভালভ ,যন্ত্রপাতি |
| Cu ,Zn | কাঁসা বা বেল মেটাল | Cu -80%,Sn - 20% | বাসনপত্র ,ঘন্টা ,মূর্তি ইত্যাদি |
| Al | ডুরালুমিন | Al - 95$,Cu - 4%, Mn -0.5%,Mg 0.5% | বিমানের কাঠামো ,মোটর গাড়ির বিভিন্ন অংশ |
| Al | মাগনেলিয়াম | Al - 90 - 95% ,Mg - 5-10 % | বিমানের যন্ত্রাংশ ,বৈজ্ঞানিক যন্ত্রপাতি |
আমালগাম : ধাতু শঙ্করের একটি উপাদান পারদ হলে তাকে আমালগাম বা পারদ সংকর বলে ।
ব্যবহার - দাঁতের চিকিৎসায় (Ag/ Hg),আয়না তৈরিতে (Sn/Hg) ব্যবহৃত হয় ।
আকরিক ও খনিজ :
খনিজ - ভূগর্ভে বা ভূত্বকে প্রাপ্ত প্রকৃতি জাত অজৈব পদার্থ যাদের মধ্যে এক বা একাধিক ধাতু প্রধানত যৌগ রূপে অন্যান্য অশুদ্ধির সঙ্গে মিশ্রিত থাকে তাদের সংশ্লিষ্ট ধাতুর খনিজ বলে ।
আকরিক - যে সমস্ত খনিজ থেকে সহজে ও লাভজনক উপায়ে উচ্চ মানের ধাতু নিষ্কাশন করা যায় তাকে আকরিক বলে । যেমন - বক্সাইট (Al₂O₃ 2H₂O),চাইনা ক্লে (Al₂O₃ 2SiO₂,2H₂O) হলো Al এর খনিজ । কিন্তূ বক্সাইট হল Al এর আকরিক কারণ বক্সাইট থেকে সহজে লাভ জনক ভাবে অ্যালুমিনিয়াম নিষ্কাশন করা যায় ।কিন্তু চাইনা ক্লে এলুমিনিয়ামের আকরিক নয় ।
খনিজ ও আকরিকের মধ্যে পার্থক্য
| খনিজ | আকরিক |
| 1. ভূপৃষ্ট বা খনি থেকে প্রকৃতিজাত কঠিনাকার ধাতব যৌগগুলি হল খনিজ । | 1.যে সমস্ত খনিজ থেকে সহজে এবং সুলভে ধাতু নিষ্কাশন করা যায় সেগুলিকে বলে আকরিক । |
| 2. সমস্ত খনিজ আকরিক নয় । | 3.সমস্ত আকরিক ই হল খনিজ । |
কয়েকটি ধাতুর আকরিকের নাম ও সংকেত
| ধাতু | আকরিকের নাম ও সংকেত |
| আয়রন | রেড হেমাটাইট (Fe₂O₃),ম্যাগনেটাইট (Fe₃O₄),স্প্যাথিক আয়রন (FeCO₃) |
| কপার | কপার (CuFeS₂),কপার গ্লান্স (Cu₂S),মালাকাইট (CuCO₃.Cu(OH)₂),কিউপ্রাইট (Cu₂O ) |
| জিংক | জিংক ব্লেন্ড (ZnS ),ক্যালামাইন (ZnCO₃),জিঙ্ক কাইট (ZnO ) |
| অ্যালুমিনিয়াম | বক্সাইট (Al₂O₃ 2H₂O),গিবসাইট (Al₂O₃ .3H₂O),ক্রায়োলাইট (AlF₃.3NaF) |
ধাতুবিদ্যা প্রসঙ্গে জারণ - বিজারণ :
জারণ - যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন বর্জন করে তাকে জারণ বলে ।
যে পরমাণু বা আয়ন ইলেকট্রন বর্জন করে সেই পরমাণু বা আয়ন জারিত হয় ।
পরমাণু থেকে ইলেকট্রন বর্জনে জারণ - Na - e → Na⁺, Ca - 2e → Ca²⁺ , Al - 3e → Al³⁺
ক্যাটায়ান থেকে ইলেকট্রন বর্জনে জারণ - Cu⁺ - e →Cu²⁺, Fe²⁺ - e → Fe³⁺
আনায়ন থেকে ইলেকট্রন বর্জনে জারণ - S²⁻ - 2e → S , 2Cl⁻ - 2e → Cl₂
বিজারণ - যে প্রক্রিয়ায় কোনো পরমাণু বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে তাকে বিজারণ বলে । পরমাণু বা আয়ন ইলেকট্রন গ্রহনের ফলে বিজারিত হয় ।
পরমাণু দ্বারা ইলেকট্রন গ্রহণে বিজারণ - Cl + e → Cl⁻ , Br + e → Br⁺ , O +2e →O²⁻
ক্যাটায়ান দ্বারা ইলেকট্রন গ্রহণে বিজারণ - Na⁺ + e →Na, Mg²⁺ + 2e → Mg
জারক ও বিজারক পদার্থ :
যে পদার্থ ইলেকট্রন গ্রহণ করে অন্যকে জারিত করে নিজে বিজারিত হয় তাকে জারক পদার্থ বলে ।
যেমন -উপরের বিক্রিয়াতে Cl,Br, Na⁺ জারক দ্রব্য ।
যে পদার্থ ইলেকট্রন বর্জন করে অপরকে বিজারিত করে নিজে জারিত হয় তাকে বিজারক পদার্থ বলে ।
যেমন - Na , Cu⁺,Ca বিজারক দ্রব্য ।
অক্সিজেনের পরিপ্রেক্ষিতে বিজারণ :
যে প্রক্রিয়ায় কোনো যৌগ থেকে অক্সিজেন বা অক্সিজেনের মতো কোনো তড়িৎ ঋণাত্মক মৌল বা মুলক অপসারিত হয় তাকে বিজারণ বলে ।
যেমন -CuO + H₂ → Cu + H₂O ,এই বিক্রিয়াতে CuO হাইড্রোজেন দ্বারা বিজারিত হয়ে Cu এ পরিণত হয়েছে ।
ধাতু নিস্কাসনের নীতি :
বিজারণ প্রক্রিয়ার সাহায্যে ধাতুর আকরিক থেকে ধাতু নিষ্কাশন করা হয় ।কি ধরনের বিজারণ বিক্রিয়ার সাহায্য নেওয়া হবে তা ধাতুটির সক্রিয়তার উপর নির্ভর করে ।ধাতুর সক্রিয়তা নির্ভর করে জল , অক্সিজেন ও লঘু এসিডের সঙ্গে বিক্রিয়া করার প্রবণতার উপর ।ধাতুগুলিকে সক্রিয়তার উপর নির্ভর করে একটি শ্রেণীতে রাখা হয়েছে ।
ধাতুর সক্রিয়তা শ্রেণী :
ধাতুগুলিকে ক্রম হ্রাসমান সক্রিয়তা অনুযাযী সাজালে যে শ্রেণী পাওয়া যায় তাকে ধাতুর সক্রিয়তা শ্রেণী বা তড়িৎ রাসায়নিক শ্রেণী বলে ।এই শ্রেণীতে যে ধাতু যত উপরে থাকে তার সক্রিয়তা তত বেশি অর্থাৎ ওই ধাতুর ইলেকট্রন ত্যাগ করে ক্যাটায়ানে পরিণত হওয়ার প্রবণতা বেশি ।
ধাতুর সক্রিয়তা শ্রেণী
| K |
| Ca |
| Na |
| Mg |
| Al |
| Zn |
| Fe |
| Sn |
| Pb |
| H |
| Cu |
| Hg |
| Ag |
| Au |
এই শ্রেণীর H এর উপরে থাকা ধাতুগুলি এসিডের সঙ্গে বিক্রিয়া করে হাইড্রোজেনকে প্রতিস্থাপিত করে ।কিন্তূ নিচে থাকা ধাতুগুলি অ্যাসিড থেকে হাইড্রোজেন নির্গত করতে পারে না ।
যেমন - Zn +2HCl → ZnCl₂ + H₂
এই সারণির উপরের দিকে থাকা ধাতু সারির নিচে অবস্থিত ধাতুর যৌগ থেকে ধাতুটিকে প্রতিস্থাপিত করে ।
যেমন - Fe + CuSO₄ →FeSO₄ + Cu
উপরের শ্রেণীর K থেকে Al পর্যন্ত ধাতুগুলির অক্সাইড কে H বা C দ্বারা বিজারিত করা যায় না ।এই সমস্ত ধাতু গুলির ক্লোরাইড বা হাইড্রোক্সাইড লবনের তড়িৎ বিশ্লেষণ দ্বারা ধাতুগুলিকে নিষ্কাশন করা হয় ।
Zn থেকে Cu পর্যন্ত ধাতুগুলির যাকারিকগুলিকে অক্সাইড এ পরিণত করে উচ্চ তাপে কার্বন বিজারণ দ্বারা বা থারমিট পদ্ধতিতে বা স্বতঃ বিজারণ দ্বারা নিষ্কাশন করা হয় ।
Hg থেকে Au ধাতুগুলির অক্সাইড কে উত্তপ্ত করলেই ধাতু নিষ্কাশিত হয় ।
ধাতু নিস্কাশনের কয়েকটি পদ্ধতি :
থারমিট পদ্ধতি :
উচ্চ উষ্নতায় Al দ্বারা কিছু ধাতুর ( Fe,Mn,Cr) অক্সাইড কে বিজারিত করে গলিত ধাতু উৎপন্ন করে । বিক্রিয়াটি তাপ দায়ী হওয়ায় উষ্নতা প্রায় 2000⁰C হয় ।তাই নিষ্কাশিত ধাতু তরল অবস্থায় থাকে ।
Fe₂O₃ + Al → Fe + Al₂O₃ + তাপ
এই পদ্ধতিতে উৎপন্ন গলিত আয়রন দ্বারা রেল লাইন জোড়া লাগানো হয় ।
 বিজারণ দ্বারা মাধ্যম সক্রিয় ধাতুর নিষ্কাশন :
বিজারণ দ্বারা মাধ্যম সক্রিয় ধাতুর নিষ্কাশন :সক্রিয়তা শ্রেণীর মাঝামাঝি অবস্থানকারী ধাতুগুলির কার্বোনেট ,সালফাইড ইত্যাদি যাকারিককে অক্সাইডে পরিণত করে কার্বণ দ্বারা উচ্চ উস্নতায় বিজারিত করে ধাতুগুলি নিষ্কাশন করা হয় । যেমন ZnO এর সঙ্গে C মিশিয়ে 1400⁰C উষ্নতায় উত্তপ্ত করলে ZnO বিজারিত হয়ে Zn উৎপন্ন করে ।
ZnO + C → Zn +CO
তড়িৎ বিশ্লেষণ দ্বারা অধিক সক্রিয় ধাতুর নিষ্কাশন :
সক্রিয়তা শ্রেণীর উপরের দিকে থাকা ধাতুগুলি খুব তড়িৎ ধনাত্মক হওয়ায় এদের অক্সাইডকে কার্বন দ্বারা বিজারিত করা যায় না ।উপযুক্ত তড়িৎ দ্বার সহ এই ধাতুগুলির গলিত হাইড্রো অক্সাইড বা ক্লোরাইড লবনের তড়িৎ বিশ্লেষণ দ্বারা ধাতুগুলিকে নিষ্কাশন করা হয় । যেমন আয়রণ ক্যাথোড এবং গ্রাফাইট এনোড ব্যবহার করে গলিত NaCl এর তড়িৎ বিশ্লেষণ করে সোডিয়াম ধাতু নিষ্কাশন করা হয় ।
NaCl → Na⁺ + Cl⁻
ক্যাথোডে : Na⁺ + e → Na (বিজারণ )
এনোডে : Cl⁻→ Cl +e (জারণ ) , Cl +Cl→Cl₂
ধাতুর ক্ষয় ।
লোহায় মরিচা ধরা ও তার প্রতিকার
লোহা বা লোহাজাত দ্রব্যকে আর্দ্র বায়ুতে খোলা অবস্থায় রেখে দিলে লোহার ওপর একটি লালচে বাদামি বর্ণের আস্তরণ পড়ে একে মরিচা বলে ।এটি এক প্রকারের সোদক ফেরিক অক্সাইড (Fe₂O₃ , x H₂O) ; x এর মান পরিবর্তণ শীল ,তবে মোটামুটিভাবে x = 3 হয় ।
মরিচা পড়ার শর্ত - অক্সিজেন এবং জলীয় বাষ্পের উপস্থিতিতে মরিচা পড়ে ।
মরিচা পড়া একটি তড়িৎ রাসায়ানিক বিক্রিয়া । আয়রন খন্ডে উপস্থিত অশুদ্ধি (কার্বন) ও অন্যান্য কারণে একটি তড়িৎ কোষের সৃষ্টি হয় ।
যে সব কারণে মরিচা পড়া ত্বরান্বিত হয় :
বায়ুতে জলীয় বাষ্পের পরিমান বাড়লে মরিচা ধরা ত্বরানিত হয় । উষ্নতা বৃদ্ধিতে মরিচা পড়ার হার বৃদ্ধি পায় ।জলে তড়িৎ বিশ্লেষ্য পদার্থ যেমন NaCl থাকলে এবং ওই জলে লোহ দ্ৰব্য আংশিক নিমজ্জিত থাকলে মরিচা পড়া ত্বরান্বিত হয় ।
মরিচা পড়া নিবারণের উপায় :
আয়রণ নির্মিত বস্তুর ওপর আলকাতরা বা রং বা বার্ণিশের প্রলেপ দিয়ে মরিচা নিবারণ করা হয় । আয়রণ নির্মিত বস্তুর উপর গলিত জিংক এর প্রলেপকে গালভানাইজেশন বলে ।এর দ্বারা মরিচা পড়া নিবারণ করা হয় ।তড়িৎ লেপন পদ্ধতিতে লোহার উপর নিকেলের বা ক্রোমিয়ামের প্রলেপ দিয়ে মরিচা পড়া থেকে বিরত রাখা যায় ।
অনুশীলনী
বাহুবিকল্প ভিত্তিক প্রশ্ন : https://forms.gle/MJHFYZxXCS73GMkM6
1.গালভানাইজেশনের কাজে কোন ধাতুটি লাগে ?
A ) Fe B) Cu C) Zn D) Al
2.এলুমিনিয়ামের আকরিক হল
A) হিমাটাইট B) গিবসাইট C) কালামাইন D) ম্যালাকাইট
3.নীচের কোনটি আয়রণের সংকর ধাতু ?
A) ডুরালুমিন B) ইনভার C) ম্যাগনেলিয়াম D) গানমেটাল
4.গোল্ডস্মিডের থারমিট পদ্ধতিতে কোন ধাতু ব্যবহৃত হয় ?
A) Fe B) Al C) Cu D) Zn
5. অতি সক্রিয় ধাতুটি হল
A) K B) Ag C) Fe D) Cu
6. লোহাতে মরিচা পড়ার জন্য প্রয়োজনীয় উপাদান
A) N₂,O₂ B) N₂,H₂ C) O₂,H₂O D) H₂O,CO₂
7.কার্বণ বিজারণ পদ্ধতিতে নিষ্কাশন করা হয়
A) Na B) K C) Ca D) Zn
8.বেসিক কপার কার্বোনেটের রং হল
A) কালো B) লাল C) বাদামী D) সবুজ
9. কপার এর একটি আকরিক হল
A) ক্যালামাইন B) কপার গ্লান্স C) বক্সাইট D) সিডেরাইট
10. হেমাটাইট নীচের কোন ধাতুর আকরিক ?
A) Cu B) Al C) Fe D) Zn