পরমাণুর গঠন (Atomic Structure) :
পরমাণুর ধারণা আমরা বিজ্ঞানী জন ডালটনের কাছ থেকে পেয়েছি । এই থেকে আমরা পরমাণু কে নিন্নরূপে সংজ্ঞায়িত করতে পারি । মৌলের অবিভাজ্য ক্ষুদ্রতম কণিকা যা রাসায়নিক বিক্রিয়াতে অংশ গ্রহণ করে এবং যার মধ্যে মৌলের সমস্ত ধৰ্ম ও গুনাগুন বজায় থাকে তাকে পরমাণু বলে । ডাল্টনের মতানুসারে পরমাণু অবিভাজ্য । কিন্তূ ক্যাথোড রশ্মি ,তেজস্ক্রিয়তা ,এক্সরশ্মি ইত্যাদি আবিষ্কারের ফলে জানা গেছে পারমাণুই ক্ষুদ্রতম কণিকা নয় । বর্তমানে জানা গেছে পরমাণু কতকগুলি আরও ক্ষুদ্রতম কণিকার দ্বারা গঠিত । এই সমস্ত কণিকাগুলির মধ্যে প্রধানত হল - ইলেকট্রন ,প্রোটন ও নিউট্রন ।
ইলেকট্রন আবিষ্কার (Discovery of electron):
0.01 mm বায়ুর চাপে কাচের তড়িৎ মোক্ষণ নলে সামান্য বায়ু রেখে ক্যাথোড ও এনোড এর মধ্যে উচ্চ বিভব পার্থক্য ( 10,000 volts) প্রয়োগ করে DC তড়িৎ প্রবাহ পাঠালে ক্যাথোড থেকে এনোড এর দিকে এক অদৃশ্য রশ্মি সরল রেখায় গমন করে এনোড প্রান্তের কাচ নলের দেয়ালে আঘাত করে সবুজ রঙের প্রতিপ্রভার সৃষ্টি করে । এই রশ্মিকে ক্যাথোড রশ্মি বলে ।

ক্যাথোড রশ্মির ধৰ্ম পর্যালোচনা করে জানা গেছে এটি হল ঋণাত্মক আধান বিশিষ্ট ইলেকট্রন কণিকার স্রোত ।
তড়িৎ মোক্ষণ নলে যেকোনো ক্যাথোড ও গ্যাস ব্যবহার করে একই রকমের ঋণাত্মক তড়িৎ বাহী কণিকা পাওয়া গেছে । এখান থেকে বলা যায় ইলেকট্রন সব মৌলের পরমাণুর একটি উপাদান কণিকা । ইলেকট্রনের আধান হল -1.602 x 10⁻¹⁹ কুলম্ব বা - 4.8 х 10⁻¹º esu | ইলেকট্রনের ভর 9.11 x 10⁻³¹ kg.
প্রোটন আবিষ্কার (Discovery of Proton):
ক্যাথোড রশ্মি উৎপাদক নলে ছিদ্রযুক্ত ক্যাথোড ব্যবহার করলে ক্যাথোড রশ্মির বিপরীত দিকে গমনশীল একটি রশ্মি পাওয়া যায় ।এই রশ্মি ধনাত্মক আধানযুক্ত হয় ।এই রশ্মিকে বলা হয় পজিটিভ বা ধনাত্মক রশ্মি ।

এই পজিটিভ রশ্মি থেকে প্রোটন আবিষ্কৃত হয়েছে ।প্রোটনের ভর 1.6725 x 10⁻²⁷ kg. ইহার আধান +1.602 x 10⁻¹⁹কুলম্ব ।প্রোটনের আধান ইলেকট্রনের আধানের সমান ,কিন্তূ বিপরীত ধর্মী ।প্রোটন ধনাত্মক তড়িৎ ধর্মী কিন্তূ ইলেকট্রন ঋণাত্মক তড়িৎ ধর্মী ।
নিউট্রন আবিষ্কার (Discovery of neutron):
বেরিলিয়াম ধাতুকে α কণিকা( ₂He⁴) দ্বারা আঘাত করলে কার্বনের C-12 আইসোটোপ ছাড়াও একটি তড়িৎ নিরপেক্ষ কণিকা পাওয়া যায় যা তড়িৎ বা চুম্বক ক্ষেত্র দ্বারা বিক্ষিপ্ত হয় না । এই নিস্তড়িৎ কণিকার নাম নিউট্রন ।
₄Be⁹ + ₂He⁴⟶ ₆C¹² +₀n¹
নিউট্রনের ভর প্রোটনের ভরের প্রায় সমান । নিউট্রনের ভর 1.675 x 10⁻²⁷ kg |
![PDF] Chadwick and the Discovery of the Neutron | Semantic Scholar](https://d3i71xaburhd42.cloudfront.net/7083470e8415e3065a41024c76d15e64d8aabbad/2-Figure1-1.png)
আধুনিক পরমাণু মডেলের ধারণা রাদারফোর্ডের α -কণা বিক্ষেপণ পরীক্ষা থেকে জানা যায় ।
রাদারফোর্ডের α -কণা বিক্ষেপণ পরীক্ষা :
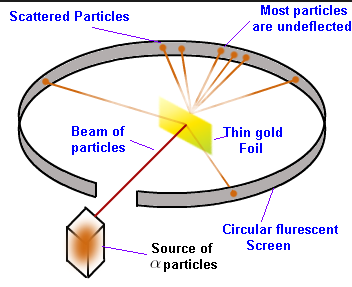

উচ্চ গতিবেগ সম্পন্ন α -কণা র গতিপথে খুব পাতলা সোনার পাত ( 0.00004 mm) রাখা হয় ।পাতটির পেছনে ZnS এর প্রলেপ একটি পর্দা রাখা হয় ।এই পর্দায় α-রশ্মি আঘাত করলে প্রতিপ্রভার সৃষ্টি হয় যার সাহায্যে α-কণার গতিপথ লক্ষ্য করা যায় । এই নিম্ন লিখিত পর্যবেক্ষন গুলি রাদারফোর্ড করেন -
1) বেশির ভাগ α কণা (প্রায় ৯৯%) সোনার পাত সরলরেখায় অবিচ্যুত থেকে অতিক্রম করে যায় ।
2)কিছু সংখ্যক আলফা কণা সামান্য কোনে বিক্ষিপ্ত হয়ে ডান বা বাম দিকে বেঁকে যায় ।
3) খুব অল্প সংখ্যক কণিকা ৯০ ⁰ বেশি কোনে বেঁকে যায় ।
4) দু একটি আলফা কণা ( প্রায় 20000 এর মধ্যে একটি ) ১৮০⁰ কোনে বিচ্যুত হয়ে যায় ।
সিদ্ধান্ত :যেহেতু বেশির ভাগ α -কণা অবিচ্যুত অবস্থায় সরলরেখায় গমন করে সুতরাং পরমাণুর বেশির ভাগ স্থান ফাঁকা । যে α কণা গুলি সামান্য কোনে বেঁকে যায় সেগুলি অবশ্যই কোনো কোনো ভারী এবং ধনাত্মক আধানযুক্ত পারমানবিক অংশের কাছ দিয়ে যায় এবং বিকর্ষণ বলের প্রভাবে বিচ্যুত হয় ।
যে α - কণা গুলি 180⁰ কোনে বিচ্যুত হয় সেই কণিকাগুলি কোনো ভারী এবং উচ্চ ধনাত্মক আধান যুক্ত অংশ দ্বারা সরাসরি বিকর্ষিত হয় ।এর দ্বারা পরমাণুর প্রায় সমস্ত ভর ও ধনাত্মক আধান ইহার কেন্দ্রে একটি অতিক্ষুদ্র স্থানে কেন্দ্রীভূত থাকে । রাদারফোর্ড এই কেন্দ্রের নাম দেন নিউক্লিয়াস । নিউক্লিয়াসের ব্যাস (10⁻¹⁵ m ) পরমাণুর ব্যাসের (10⁻¹ºm ) 100000 ভাগের এক ভাগ ।ইলেকট্রন গুলি নিউক্লিয়াসের বাহিরে ফাঁকা স্থানে অবস্থান করে ।যেহেতু আলফা কণা ইলেকট্রন অপেক্ষা বহুগুণ ভারী (প্রায় ৭৫০০ গুন্) সেই জন্য পরমাণুর ভিতর যাবার সময় α -কণা এর গতি ইলেকট্রন দ্বারা প্রভাবিত হয় না ।
রাদারফোর্ডের পরমাণু মডেল :
রাদারফোর্ড পরমাণু মডেলের দুটি অংশ ।1) নিউক্লিয়াস 2)ইলেকট্রন মহল ।
1) নিউক্লিয়াস - পরমাণুর সমস্ত ভর ও ধনাত্মক আধান নিউক্লিয়াসে কেন্দ্রিভুত থাকে । নিউক্লিয়াসের ব্যাস প্রায় 10⁻¹⁵ m | পরমাণুর ব্যাস 10⁻¹º m | সুতরাং নিউক্লিয়াসের আয়তন পরমাণুর আয়তনের তুলনায় অতি নগন্য ।
নিউক্লিয়াসটি পজিটিভ তড়িৎ গ্রস্ত কণা প্রোটন ও নিস্তড়িৎ কণিকা নিউট্রন দ্বারা গঠিত । পরমাণুর ভর প্রায় ওহার নিউক্লিয়াসের ভরের সঙ্গে সমান ,কারণ ইলেকট্রনের ভর নগণ্য ।
2) ইলেকট্রন মহল : পরমাণু নিস্তড়িৎ হওয়ায় নিউক্লিয়াসে যতগুলি ধনাত্মক কণিকা প্রোটন থাকে ঠিক তত গুলি ঋণাত্মক ইলেকট্রন নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন কক্ষে তীব্র বেগে আবর্তন করতে থাকে । ইলেকট্রন গুলি ঘূর্ণনের ফলে উৎপন্ন অপকেন্দ্রিক বল নিউক্লিয়াস ও ইলেকট্রনের মধ্যে ক্রিয়াশীল স্থির তড়িৎআকর্ষণ বলের সমান ও বিপরীত হয় ।ফলে ইলেকট্রন গুলি নিউক্লিয়াসে এসে পড়ে না ।

রাদারফোর্ড পরমাণু মডেলের সীমাবদ্ধতা :
ইলেক্ট্রনগুলি তড়িৎ ধর্মী কণিকা এবং ঘূর্ণনশীল থাকায় উহার ত্বরণ উৎপন্ন হয় । তড়িৎ চুম্বকীয় তত্ত্ব অনুযায়ী ত্বরণ যুক্ত তড়িৎ কণা শক্তি বিকিরণ করে । ফলে ইলেক্ট্রনগুলির শক্তি ক্রমশ কমতে থাকবে এবং উহার কক্ষপথের ব্যাসার্ধ ক্রমশ ছোট হবে ।শেষ পর্যন্ত ইলেকট্রন গুলি নিউক্লিয়াসে এসে পড়বে । সুতরাং এখানে ইলেকট্রনের কক্ষপথের সুস্থিতির ব্যাখ্যা নেই ।
তড়িৎ চুম্বকীয় তত্ত্ব অনুসারে ঘূর্ণায়মান ইলেকট্রন গুলির দ্বারা নিরবিচ্ছিন্ন বর্ণালী উৎপন্ন হওয়ার কথা ।কিন্তূ পরমাণু থেকে রেখা বর্ণালী পাওয়া যায় । সুতরাং রাথারফোর্ডের পরমাণু মডেল রেখা বর্ণালী ব্যাখ্যা করতে পারে না ।

বোর -রাদারফোর্ড পরমাণু মডেল :
রাদারফোর্ড পরমাণু মডেলের ত্রুটি অর্থাৎ পরমাণুর স্থায়িত্ব ব্যাখ্যা করার জন্য নিলস বোর একটি পরমাণু মডেলের ধারণা দেন যা বোর -রাদারফোর্ড মডেল নামে পরিচিত । এই পরমাণু মডেলের স্বিকার্য্য গুলি হল -
1) পরমাণুর নিউক্লিয়াস কে ঘিরে কতকগুলি সুনিদিষ্ট ব্যাসার্ধের কক্ষ পথ আছে ।এই কক্ষ পথগুলিকে সুস্থির কক্ষ (Stationary)পথ বলে | যখন কোনো ইলেকট্রন এই সুস্থির কক্ষ পথে ঘুরে তখন কোনো শক্তিগ্রহণ বা বর্জন ঘটে না । এই কক্ষ পথে ইলেকট্রনের অবস্থান কালে ইলেকট্রনের শক্তি স্থির থাকে । প্রত্যেকটি সুস্থির কক্ষপথের একটি নিৰ্দিষ্ট শক্তি থাকে । কক্ষ পথগুলিকে নিউক্লিয়াস থেকে ক্রমশ দূরত্ব অনুসারে 1,2,34 .........ইত্যাদি সংখ্যা দ্বারা চিহ্নিত করা হয় বা K,L,M,N ....অক্ষর দ্বারাও চিহ্নিত করা হয় । কক্ষ পথ নিৰ্দেশকারী সংখ্যাগুলিকে মুখ্য কুয়ান্টাম সংখ্যা(Principal quantum number) বলা হয় ।
2) নিউক্লিয়াস থেকে কক্ষ গুলির দূরত্ব যত বেশি হয় কক্ষ গুলির শক্তিও তত বেশি হয় । প্রথম ,দ্বিতীয় ,তৃতীয় ইত্যাদি কক্ষ গুলির শক্তি যথাক্রমে E₁,E₂,E₃,E₄ হলে E₁< E₂<E₃<E₄ ... হবে ।
3) যখন কোনো ইলেকট্রন এক কক্ষ পথ থেকে অন্য কক্ষ পথে গমন করে তখন ইলেকট্রন শক্তি গ্রহণ বা বর্জন করে । যখন ইলেক্ট্রনটি উচ্চ শক্তিস্তর থেকে নিম্ন শক্তিস্তরে গমন করে তখন শক্তি বিকিরণ করে ।আর যখন নিম্ন শক্তিস্তর থেকে উচ্চ শক্তিস্তরে গমন করে তখন শক্তি গ্রহণ বা শোষণ করে ।


বোরের তত্ত্ব অনুসারে যখন ইলেকট্রন কোনো নিৰ্দিষ্ট কক্ষ পথে ঘুরে তখন কোনো শক্তি বিকিরণ করে না তাই এই পরমাণু মডেল পরমাণুর স্থায়িত্ব ব্যাখ্যা সক্ষম ।
পারমানবিক সংখ্যা(Atomic Number) :
কোনো মৌলের পরমাণুর নিউক্লিয়াসে যত সংখ্যক প্রোটন থাকে সেই সংখ্যাকে ওই মৌলের পারমানবিক বা পরমাণু ক্রমাঙ্ক সংখ্যা বলে ।
পারমানবিক সংখ্যা = প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা ।
ভর সংখ্যা (Mass Number):
কোনো মৌলের পরমাণুর নিউক্লিয়াসে অবস্থিত প্রোটন ও নিউট্রণ সংখ্যার সমষ্টিকে মৌলটির ভরসংখ্যা বলে ।
ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রণ সংখ্যা ।
কোনো মৌলের পারমানবিক সংখ্যা ও ভরসংখ্যা নিন্ন লিখিত ভাবে প্রকাশিত করা হয় ।
যেমন - ₁₃Al²⁷ বা ₁₃²⁷Al দ্বারা এলুমিনিয়ামের নিউক্লিয়াসকে বোঝানো হয়েছে , যার পারমানবিক সংখ্যা 13, ভরসংখ্যা 27 |
সমস্থানিক বা আইসোটোপ :
একই মৌলের বিভিন্ন পরমাণু পারমানবিক সংখ্যা একই কিন্তূ নিউক্লিয়াসে বিভিন্ন সংখ্যক নিউট্রন থাকার জন্য ভরসংখ্যা বিভিন্ন হয় তাদের পরস্পরের আইসোটোপ বলে ।আইসোটোপ গুলির রাসায়নিক ধৰ্ম একই হয় ।
হাইড্রোজেনের তিনটি আইসোটোপ আছে যাদের ভরসংখ্যা যথাক্রমে 1,2,3 ; তিনটির পারমানবিক সংখ্যা 1 |

কার্বনের আইসোটোপ

কার্বনের তিনটি আইসোটোপ আছে ,যাদের ভর সংখ্যা যথাক্রমে 12,13,14 | তিনটির পারমানবিক সংখ্যা 6 |
ক্লোরিনের আইসোটোপ :
ক্লোরিনের দুই টি আইসোটোপ আছে যাদের ভরসংখ্যা যথাক্রমে ৩৫ এবং ৩৭ । উভয়ের পারমানবিক সংখ্যা ১৭ ।
অক্সিজেনের আইসোটোপ :

অক্সিজেনের তিনটি আইসোটোপ পাওয়া যায় । এদের ভরসংখ্যা যথাক্রমে ১৬,১৭,১৮ । সবগুলির পারমানবিক সংখ্যা ৮ । এদের নিউট্রন সংখ্যা যথাক্রমে ১৬ -৮ = ৮,১৭ -৮ = ৯, ১৮-৮ = ১০ ।
আইসোবার (Isobar ):
বিভিন্ন মৌলের যে সকল পরমাণুর ভরসংখ্যা একই কিন্তূ পারমানবিক সংখ্যা আলাদা তাদেরকে পরস্পরের আইসোবার বলে । আইসবার গুলি বিভিন্ন মৌলের হওয়ায় এদের রাসায়নিক ধৰ্ম ভিন্ন হয় ।

আইসোটোন (Isotone):
বিভিন্ন মৌলের যেসকল পরমাণুর নিউট্রন সংখ্যা সমান কিন্তূ প্রোটন সংখ্যা আলাদা তাদের আইসো টোন বলে ।


নিউক্লিও বল (Nuclear Force ) :
π মেসন কণিকার আদান প্রদানের মাধ্যমে নিউক্লিয়াসের মধ্যস্থ প্রোটন ও নিউট্রনের পারস্পরিক রূপান্তর হয় । এর ফলে উদ্ভুত তীব্র আকর্ষণ বল প্রোটন ও নিউট্রনগুলিকে একসঙ্গে ধরে রাখে । এই আকর্ষণ বলের নাম নিউক্লিও বল
নিউক্লিও বলের বৈশিষ্ট :
নিউক্লিও বল মহাকর্ষীয় বা স্থির তড়িৎ বল অপেক্ষা ভিন্ন প্রকৃতির । এই নিউক্লিও বল মহাকর্ষীয় বল অপেক্ষা প্রায় 10⁴⁰ গুন শক্তিশালী আকর্ষণ বল । নিউক্লিও বল ব্যাস্ত বর্গ নিয়ম মেনে চলে না । এই বল খুব কম দূরত্বের(১.৫ ফার্মি ) মধ্যে কার্যকরী হয় (1 ফার্মি = 10⁻¹⁵ m)
পরমাণুর ইলেকট্রন বিন্যাস :
পরমাণুর বিভিন্ন শক্তি স্তরে ইলেকট্রনের ক্রমান্বয়িক সজ্জাকে ইলেকট্রন বিন্যাস বলে । নিম্নের নিয়ম অনুসারে ইলেকট্রন গুলি পরমাণুর বিভিন্ন শক্তিস্তরে বিন্যস্থ হয় ।
১) n তম শক্তিস্থরে সর্বোচ্চ ইলেকট্রন সংখ্যা 2n² | তবে n >4 হলে সংশ্লিষ্ট কক্ষে 32 টির বেশি ইলেকট্রন থাকতে পারে না ।
এই নিয়ম অনুসারে প্রথম কক্ষে (K কক্ষ ) সর্বোচ্চ ইলেক্ট্রন সংখ্যা 2 ( 2 x 1²) |
দ্বিয়ীয কক্ষে সর্বোচ্চ ইলেক্ট্রন সংখ্যা 8 (2 x 2²) |
তৃতীয় কক্ষে সর্বচ্চো ইলেকট্রন সংখ্যা 18 (2 x 3²) |
চতুর্থ কক্ষে ইলেকট্রন সংখ্যা 32 (2 x 4² ) |
2) বহিস্ত শক্তিস্তরে 8 টির বেশি ইলেকট্রন থাকতে পারে না এবং তার আগের কক্ষে 18 টির বেশি ইলেকট্রন থাকতে পারে না ।

কক্ষ থেকে কক্ষান্তরে ইলেট্রনের গমনের ফলে শক্তির বিকিরণ বা শোষণ :

বাহ্যিক শক্তি (আলো ইত্যাদি ) প্রয়োগ করলে কোনো কক্ষ পথে থাকা ইলেকট্রন ওই শক্তি শোষণ করে এলেক্ট্রনটি নিম্ন শক্তিস্তর থেকে উচ্চ শক্তিস্তরে গমণ করে ।পরমাণুর এই অবস্থাকে উদীপ্ত (excited ) অবস্থা বলে ।
নিন্ন শক্তিস্তরে ইলেকট্রনের শক্তি E₁ এবং উচ্চ শক্তিস্তরে E₂ হলে ইলেকট্রন দ্বারা শোষিত শক্তির পরিমান E₂ - E₁ |
আবার উদীপ্ত অবস্থা থেকে স্বাভাবিক (Ground) অবস্থায় যখন ইলেকট্রন ফিরে আসে তখন বিকিরিত শক্তির পরিমান E₂ - E₁ ।

ইলেকট্রন আবিষ্কার (Discovery of electron):
0.01 mm বায়ুর চাপে কাচের তড়িৎ মোক্ষণ নলে সামান্য বায়ু রেখে ক্যাথোড ও এনোড এর মধ্যে উচ্চ বিভব পার্থক্য ( 10,000 volts) প্রয়োগ করে DC তড়িৎ প্রবাহ পাঠালে ক্যাথোড থেকে এনোড এর দিকে এক অদৃশ্য রশ্মি সরল রেখায় গমন করে এনোড প্রান্তের কাচ নলের দেয়ালে আঘাত করে সবুজ রঙের প্রতিপ্রভার সৃষ্টি করে । এই রশ্মিকে ক্যাথোড রশ্মি বলে ।

ক্যাথোড রশ্মির ধৰ্ম পর্যালোচনা করে জানা গেছে এটি হল ঋণাত্মক আধান বিশিষ্ট ইলেকট্রন কণিকার স্রোত ।
তড়িৎ মোক্ষণ নলে যেকোনো ক্যাথোড ও গ্যাস ব্যবহার করে একই রকমের ঋণাত্মক তড়িৎ বাহী কণিকা পাওয়া গেছে । এখান থেকে বলা যায় ইলেকট্রন সব মৌলের পরমাণুর একটি উপাদান কণিকা । ইলেকট্রনের আধান হল -1.602 x 10⁻¹⁹ কুলম্ব বা - 4.8 х 10⁻¹º esu | ইলেকট্রনের ভর 9.11 x 10⁻³¹ kg.
প্রোটন আবিষ্কার (Discovery of Proton):
ক্যাথোড রশ্মি উৎপাদক নলে ছিদ্রযুক্ত ক্যাথোড ব্যবহার করলে ক্যাথোড রশ্মির বিপরীত দিকে গমনশীল একটি রশ্মি পাওয়া যায় ।এই রশ্মি ধনাত্মক আধানযুক্ত হয় ।এই রশ্মিকে বলা হয় পজিটিভ বা ধনাত্মক রশ্মি ।
এই পজিটিভ রশ্মি থেকে প্রোটন আবিষ্কৃত হয়েছে ।প্রোটনের ভর 1.6725 x 10⁻²⁷ kg. ইহার আধান +1.602 x 10⁻¹⁹কুলম্ব ।প্রোটনের আধান ইলেকট্রনের আধানের সমান ,কিন্তূ বিপরীত ধর্মী ।প্রোটন ধনাত্মক তড়িৎ ধর্মী কিন্তূ ইলেকট্রন ঋণাত্মক তড়িৎ ধর্মী ।
নিউট্রন আবিষ্কার (Discovery of neutron):
বেরিলিয়াম ধাতুকে α কণিকা( ₂He⁴) দ্বারা আঘাত করলে কার্বনের C-12 আইসোটোপ ছাড়াও একটি তড়িৎ নিরপেক্ষ কণিকা পাওয়া যায় যা তড়িৎ বা চুম্বক ক্ষেত্র দ্বারা বিক্ষিপ্ত হয় না । এই নিস্তড়িৎ কণিকার নাম নিউট্রন ।
₄Be⁹ + ₂He⁴⟶ ₆C¹² +₀n¹
নিউট্রনের ভর প্রোটনের ভরের প্রায় সমান । নিউট্রনের ভর 1.675 x 10⁻²⁷ kg |
![PDF] Chadwick and the Discovery of the Neutron | Semantic Scholar](https://d3i71xaburhd42.cloudfront.net/7083470e8415e3065a41024c76d15e64d8aabbad/2-Figure1-1.png)
আধুনিক পরমাণু মডেলের ধারণা রাদারফোর্ডের α -কণা বিক্ষেপণ পরীক্ষা থেকে জানা যায় ।
রাদারফোর্ডের α -কণা বিক্ষেপণ পরীক্ষা :

উচ্চ গতিবেগ সম্পন্ন α -কণা র গতিপথে খুব পাতলা সোনার পাত ( 0.00004 mm) রাখা হয় ।পাতটির পেছনে ZnS এর প্রলেপ একটি পর্দা রাখা হয় ।এই পর্দায় α-রশ্মি আঘাত করলে প্রতিপ্রভার সৃষ্টি হয় যার সাহায্যে α-কণার গতিপথ লক্ষ্য করা যায় । এই নিম্ন লিখিত পর্যবেক্ষন গুলি রাদারফোর্ড করেন -
1) বেশির ভাগ α কণা (প্রায় ৯৯%) সোনার পাত সরলরেখায় অবিচ্যুত থেকে অতিক্রম করে যায় ।
2)কিছু সংখ্যক আলফা কণা সামান্য কোনে বিক্ষিপ্ত হয়ে ডান বা বাম দিকে বেঁকে যায় ।
3) খুব অল্প সংখ্যক কণিকা ৯০ ⁰ বেশি কোনে বেঁকে যায় ।
4) দু একটি আলফা কণা ( প্রায় 20000 এর মধ্যে একটি ) ১৮০⁰ কোনে বিচ্যুত হয়ে যায় ।
সিদ্ধান্ত :যেহেতু বেশির ভাগ α -কণা অবিচ্যুত অবস্থায় সরলরেখায় গমন করে সুতরাং পরমাণুর বেশির ভাগ স্থান ফাঁকা । যে α কণা গুলি সামান্য কোনে বেঁকে যায় সেগুলি অবশ্যই কোনো কোনো ভারী এবং ধনাত্মক আধানযুক্ত পারমানবিক অংশের কাছ দিয়ে যায় এবং বিকর্ষণ বলের প্রভাবে বিচ্যুত হয় ।
যে α - কণা গুলি 180⁰ কোনে বিচ্যুত হয় সেই কণিকাগুলি কোনো ভারী এবং উচ্চ ধনাত্মক আধান যুক্ত অংশ দ্বারা সরাসরি বিকর্ষিত হয় ।এর দ্বারা পরমাণুর প্রায় সমস্ত ভর ও ধনাত্মক আধান ইহার কেন্দ্রে একটি অতিক্ষুদ্র স্থানে কেন্দ্রীভূত থাকে । রাদারফোর্ড এই কেন্দ্রের নাম দেন নিউক্লিয়াস । নিউক্লিয়াসের ব্যাস (10⁻¹⁵ m ) পরমাণুর ব্যাসের (10⁻¹ºm ) 100000 ভাগের এক ভাগ ।ইলেকট্রন গুলি নিউক্লিয়াসের বাহিরে ফাঁকা স্থানে অবস্থান করে ।যেহেতু আলফা কণা ইলেকট্রন অপেক্ষা বহুগুণ ভারী (প্রায় ৭৫০০ গুন্) সেই জন্য পরমাণুর ভিতর যাবার সময় α -কণা এর গতি ইলেকট্রন দ্বারা প্রভাবিত হয় না ।
রাদারফোর্ডের পরমাণু মডেল :
রাদারফোর্ড পরমাণু মডেলের দুটি অংশ ।1) নিউক্লিয়াস 2)ইলেকট্রন মহল ।
1) নিউক্লিয়াস - পরমাণুর সমস্ত ভর ও ধনাত্মক আধান নিউক্লিয়াসে কেন্দ্রিভুত থাকে । নিউক্লিয়াসের ব্যাস প্রায় 10⁻¹⁵ m | পরমাণুর ব্যাস 10⁻¹º m | সুতরাং নিউক্লিয়াসের আয়তন পরমাণুর আয়তনের তুলনায় অতি নগন্য ।
নিউক্লিয়াসটি পজিটিভ তড়িৎ গ্রস্ত কণা প্রোটন ও নিস্তড়িৎ কণিকা নিউট্রন দ্বারা গঠিত । পরমাণুর ভর প্রায় ওহার নিউক্লিয়াসের ভরের সঙ্গে সমান ,কারণ ইলেকট্রনের ভর নগণ্য ।
2) ইলেকট্রন মহল : পরমাণু নিস্তড়িৎ হওয়ায় নিউক্লিয়াসে যতগুলি ধনাত্মক কণিকা প্রোটন থাকে ঠিক তত গুলি ঋণাত্মক ইলেকট্রন নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন কক্ষে তীব্র বেগে আবর্তন করতে থাকে । ইলেকট্রন গুলি ঘূর্ণনের ফলে উৎপন্ন অপকেন্দ্রিক বল নিউক্লিয়াস ও ইলেকট্রনের মধ্যে ক্রিয়াশীল স্থির তড়িৎআকর্ষণ বলের সমান ও বিপরীত হয় ।ফলে ইলেকট্রন গুলি নিউক্লিয়াসে এসে পড়ে না ।

রাদারফোর্ড পরমাণু মডেলের সীমাবদ্ধতা :
ইলেক্ট্রনগুলি তড়িৎ ধর্মী কণিকা এবং ঘূর্ণনশীল থাকায় উহার ত্বরণ উৎপন্ন হয় । তড়িৎ চুম্বকীয় তত্ত্ব অনুযায়ী ত্বরণ যুক্ত তড়িৎ কণা শক্তি বিকিরণ করে । ফলে ইলেক্ট্রনগুলির শক্তি ক্রমশ কমতে থাকবে এবং উহার কক্ষপথের ব্যাসার্ধ ক্রমশ ছোট হবে ।শেষ পর্যন্ত ইলেকট্রন গুলি নিউক্লিয়াসে এসে পড়বে । সুতরাং এখানে ইলেকট্রনের কক্ষপথের সুস্থিতির ব্যাখ্যা নেই ।
তড়িৎ চুম্বকীয় তত্ত্ব অনুসারে ঘূর্ণায়মান ইলেকট্রন গুলির দ্বারা নিরবিচ্ছিন্ন বর্ণালী উৎপন্ন হওয়ার কথা ।কিন্তূ পরমাণু থেকে রেখা বর্ণালী পাওয়া যায় । সুতরাং রাথারফোর্ডের পরমাণু মডেল রেখা বর্ণালী ব্যাখ্যা করতে পারে না ।

বোর -রাদারফোর্ড পরমাণু মডেল :
রাদারফোর্ড পরমাণু মডেলের ত্রুটি অর্থাৎ পরমাণুর স্থায়িত্ব ব্যাখ্যা করার জন্য নিলস বোর একটি পরমাণু মডেলের ধারণা দেন যা বোর -রাদারফোর্ড মডেল নামে পরিচিত । এই পরমাণু মডেলের স্বিকার্য্য গুলি হল -
1) পরমাণুর নিউক্লিয়াস কে ঘিরে কতকগুলি সুনিদিষ্ট ব্যাসার্ধের কক্ষ পথ আছে ।এই কক্ষ পথগুলিকে সুস্থির কক্ষ (Stationary)পথ বলে | যখন কোনো ইলেকট্রন এই সুস্থির কক্ষ পথে ঘুরে তখন কোনো শক্তিগ্রহণ বা বর্জন ঘটে না । এই কক্ষ পথে ইলেকট্রনের অবস্থান কালে ইলেকট্রনের শক্তি স্থির থাকে । প্রত্যেকটি সুস্থির কক্ষপথের একটি নিৰ্দিষ্ট শক্তি থাকে । কক্ষ পথগুলিকে নিউক্লিয়াস থেকে ক্রমশ দূরত্ব অনুসারে 1,2,34 .........ইত্যাদি সংখ্যা দ্বারা চিহ্নিত করা হয় বা K,L,M,N ....অক্ষর দ্বারাও চিহ্নিত করা হয় । কক্ষ পথ নিৰ্দেশকারী সংখ্যাগুলিকে মুখ্য কুয়ান্টাম সংখ্যা(Principal quantum number) বলা হয় ।
2) নিউক্লিয়াস থেকে কক্ষ গুলির দূরত্ব যত বেশি হয় কক্ষ গুলির শক্তিও তত বেশি হয় । প্রথম ,দ্বিতীয় ,তৃতীয় ইত্যাদি কক্ষ গুলির শক্তি যথাক্রমে E₁,E₂,E₃,E₄ হলে E₁< E₂<E₃<E₄ ... হবে ।
3) যখন কোনো ইলেকট্রন এক কক্ষ পথ থেকে অন্য কক্ষ পথে গমন করে তখন ইলেকট্রন শক্তি গ্রহণ বা বর্জন করে । যখন ইলেক্ট্রনটি উচ্চ শক্তিস্তর থেকে নিম্ন শক্তিস্তরে গমন করে তখন শক্তি বিকিরণ করে ।আর যখন নিম্ন শক্তিস্তর থেকে উচ্চ শক্তিস্তরে গমন করে তখন শক্তি গ্রহণ বা শোষণ করে ।


বোরের তত্ত্ব অনুসারে যখন ইলেকট্রন কোনো নিৰ্দিষ্ট কক্ষ পথে ঘুরে তখন কোনো শক্তি বিকিরণ করে না তাই এই পরমাণু মডেল পরমাণুর স্থায়িত্ব ব্যাখ্যা সক্ষম ।
পারমানবিক সংখ্যা(Atomic Number) :
কোনো মৌলের পরমাণুর নিউক্লিয়াসে যত সংখ্যক প্রোটন থাকে সেই সংখ্যাকে ওই মৌলের পারমানবিক বা পরমাণু ক্রমাঙ্ক সংখ্যা বলে ।
পারমানবিক সংখ্যা = প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা ।
ভর সংখ্যা (Mass Number):
কোনো মৌলের পরমাণুর নিউক্লিয়াসে অবস্থিত প্রোটন ও নিউট্রণ সংখ্যার সমষ্টিকে মৌলটির ভরসংখ্যা বলে ।
ভরসংখ্যা = প্রোটন সংখ্যা + নিউট্রণ সংখ্যা ।
কোনো মৌলের পারমানবিক সংখ্যা ও ভরসংখ্যা নিন্ন লিখিত ভাবে প্রকাশিত করা হয় ।
যেমন - ₁₃Al²⁷ বা ₁₃²⁷Al দ্বারা এলুমিনিয়ামের নিউক্লিয়াসকে বোঝানো হয়েছে , যার পারমানবিক সংখ্যা 13, ভরসংখ্যা 27 |
সমস্থানিক বা আইসোটোপ :
একই মৌলের বিভিন্ন পরমাণু পারমানবিক সংখ্যা একই কিন্তূ নিউক্লিয়াসে বিভিন্ন সংখ্যক নিউট্রন থাকার জন্য ভরসংখ্যা বিভিন্ন হয় তাদের পরস্পরের আইসোটোপ বলে ।আইসোটোপ গুলির রাসায়নিক ধৰ্ম একই হয় ।
হাইড্রোজেনের তিনটি আইসোটোপ আছে যাদের ভরসংখ্যা যথাক্রমে 1,2,3 ; তিনটির পারমানবিক সংখ্যা 1 |
কার্বনের আইসোটোপ
কার্বনের তিনটি আইসোটোপ আছে ,যাদের ভর সংখ্যা যথাক্রমে 12,13,14 | তিনটির পারমানবিক সংখ্যা 6 |
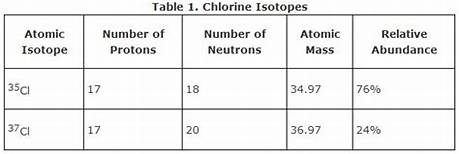
ক্লোরিনের আইসোটোপ :
ক্লোরিনের দুই টি আইসোটোপ আছে যাদের ভরসংখ্যা যথাক্রমে ৩৫ এবং ৩৭ । উভয়ের পারমানবিক সংখ্যা ১৭ ।
অক্সিজেনের আইসোটোপ :
অক্সিজেনের তিনটি আইসোটোপ পাওয়া যায় । এদের ভরসংখ্যা যথাক্রমে ১৬,১৭,১৮ । সবগুলির পারমানবিক সংখ্যা ৮ । এদের নিউট্রন সংখ্যা যথাক্রমে ১৬ -৮ = ৮,১৭ -৮ = ৯, ১৮-৮ = ১০ ।
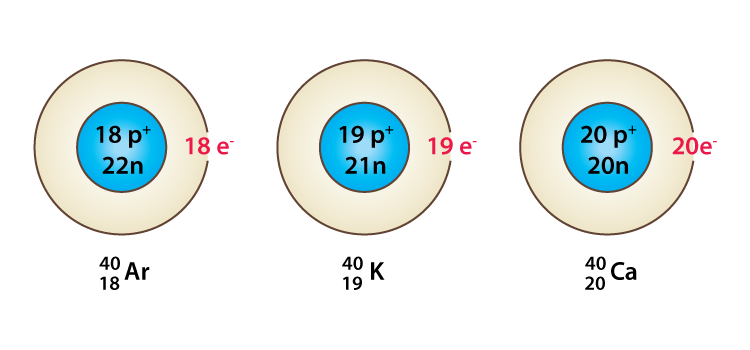
আইসোবার (Isobar ):
বিভিন্ন মৌলের যে সকল পরমাণুর ভরসংখ্যা একই কিন্তূ পারমানবিক সংখ্যা আলাদা তাদেরকে পরস্পরের আইসোবার বলে । আইসবার গুলি বিভিন্ন মৌলের হওয়ায় এদের রাসায়নিক ধৰ্ম ভিন্ন হয় ।

আইসোটোন (Isotone):
বিভিন্ন মৌলের যেসকল পরমাণুর নিউট্রন সংখ্যা সমান কিন্তূ প্রোটন সংখ্যা আলাদা তাদের আইসো টোন বলে ।
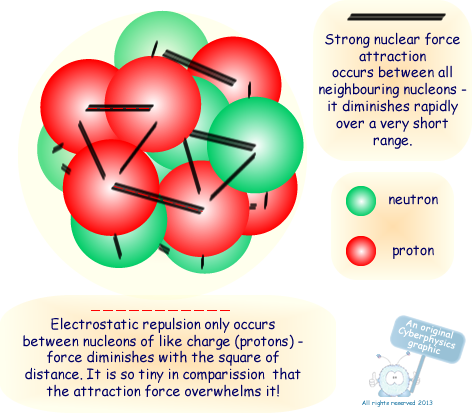
নিউক্লিও বল (Nuclear Force ) :
π মেসন কণিকার আদান প্রদানের মাধ্যমে নিউক্লিয়াসের মধ্যস্থ প্রোটন ও নিউট্রনের পারস্পরিক রূপান্তর হয় । এর ফলে উদ্ভুত তীব্র আকর্ষণ বল প্রোটন ও নিউট্রনগুলিকে একসঙ্গে ধরে রাখে । এই আকর্ষণ বলের নাম নিউক্লিও বল

নিউক্লিও বলের বৈশিষ্ট :
নিউক্লিও বল মহাকর্ষীয় বা স্থির তড়িৎ বল অপেক্ষা ভিন্ন প্রকৃতির । এই নিউক্লিও বল মহাকর্ষীয় বল অপেক্ষা প্রায় 10⁴⁰ গুন শক্তিশালী আকর্ষণ বল । নিউক্লিও বল ব্যাস্ত বর্গ নিয়ম মেনে চলে না । এই বল খুব কম দূরত্বের(১.৫ ফার্মি ) মধ্যে কার্যকরী হয় (1 ফার্মি = 10⁻¹⁵ m)
পরমাণুর ইলেকট্রন বিন্যাস :
পরমাণুর বিভিন্ন শক্তি স্তরে ইলেকট্রনের ক্রমান্বয়িক সজ্জাকে ইলেকট্রন বিন্যাস বলে । নিম্নের নিয়ম অনুসারে ইলেকট্রন গুলি পরমাণুর বিভিন্ন শক্তিস্তরে বিন্যস্থ হয় ।
১) n তম শক্তিস্থরে সর্বোচ্চ ইলেকট্রন সংখ্যা 2n² | তবে n >4 হলে সংশ্লিষ্ট কক্ষে 32 টির বেশি ইলেকট্রন থাকতে পারে না ।
এই নিয়ম অনুসারে প্রথম কক্ষে (K কক্ষ ) সর্বোচ্চ ইলেক্ট্রন সংখ্যা 2 ( 2 x 1²) |
দ্বিয়ীয কক্ষে সর্বোচ্চ ইলেক্ট্রন সংখ্যা 8 (2 x 2²) |
তৃতীয় কক্ষে সর্বচ্চো ইলেকট্রন সংখ্যা 18 (2 x 3²) |
চতুর্থ কক্ষে ইলেকট্রন সংখ্যা 32 (2 x 4² ) |
2) বহিস্ত শক্তিস্তরে 8 টির বেশি ইলেকট্রন থাকতে পারে না এবং তার আগের কক্ষে 18 টির বেশি ইলেকট্রন থাকতে পারে না ।

কক্ষ থেকে কক্ষান্তরে ইলেট্রনের গমনের ফলে শক্তির বিকিরণ বা শোষণ :

বাহ্যিক শক্তি (আলো ইত্যাদি ) প্রয়োগ করলে কোনো কক্ষ পথে থাকা ইলেকট্রন ওই শক্তি শোষণ করে এলেক্ট্রনটি নিম্ন শক্তিস্তর থেকে উচ্চ শক্তিস্তরে গমণ করে ।পরমাণুর এই অবস্থাকে উদীপ্ত (excited ) অবস্থা বলে ।
নিন্ন শক্তিস্তরে ইলেকট্রনের শক্তি E₁ এবং উচ্চ শক্তিস্তরে E₂ হলে ইলেকট্রন দ্বারা শোষিত শক্তির পরিমান E₂ - E₁ |
আবার উদীপ্ত অবস্থা থেকে স্বাভাবিক (Ground) অবস্থায় যখন ইলেকট্রন ফিরে আসে তখন বিকিরিত শক্তির পরিমান E₂ - E₁ ।

পরমানূর্ আয়নীয়ভবন
বাহ্যিক শক্তি যথা তাপ বা আলোক শক্তি প্রয়োগ করলে পরমাণুর বহিঃস্ত কক্ষ থেকে ইলেকট্রন নিউক্লিয়াসের আকর্ষণ ছাড়িয়ে পরমাণু থেকে অপসারিত হয় এবং পারমাণুটি ক্যাটায়নে পরিণত হয় । এক্ষেত্রে প্রদত্ত শক্তিকে আয়োনীভবন শক্তি বলে ।
গ্যাসীয় অবস্থায় একটি বিচ্ছিন্ন পরমাণুর সর্ববহিস্ত কক্ষ পথ থেকে একটি ইলেক্ট্রনকে নিউক্লিয়াসের আকর্ষণ থেকে মুক্ত করে একক ধনাত্মক আয়ন এ পরিণত করতে যে সর্বনিম্ন শক্তি প্রয়োগ করতে হয় তাকে ওই মৌলের প্রথম আয়নন শক্তি বা আয়নন বিভব বলে ।
বিভিন্ন প্রকারের আয়নন পদ্ধতি :
1) তাপীয় আয়নন : কিছু ধাতুকে(টাংস্টেন ) উচ্চ তাপমাত্রায় উত্তপ্ত করলে ইলেকট্রন নির্গত হয় এবং পরমাণু গুলি ধনাত্মক আয়ন এ পরিণত হয় ।একে ধাতুর তাপিয় আয়নন বলে ।
2) অতি বেগুনি রশ্মির প্রভাবে আয়নন : ক্ষার ধাতু ( সোডিয়াম ,পটাসিয়াম ইত্যাদি ) উপর অতি বেগুনিরশ্মি পড়লে ধাতুর উপরিতল থেকে ইলেকট্রন নিঃসৃত হয় এবং ক্যাটায়ন উৎপন্ন হয় ।
নীচের MCQ গুলির উত্তর দাও :( প্রদত্ত LINK টিতে ক্লিক কর )



কোন মন্তব্য নেই:
একটি মন্তব্য পোস্ট করুন