জৈব রসায়ন (Organic Chemistry):
জৈব যৌগ -
কার্বনের অক্সাইড ,ধাতব কার্বনেট ও বাইকার্বোনেট ,ধাতব সায়ানাইড এবং হাইড্রোজেন সায়ানাইড বাদে কার্বন দ্বারা গঠিত যে যৌগ গুলির মধ্যে কার্বনের ক্যাটিনেশন ধৰ্ম ,সমবয়তা বৈশিষ্ট দেখা যায় তাদের জৈব যৌগ বলে ।

জৈব রসায়ন:
জৈব যৌগের রসায়ন কে জৈব রসায়ন বলে ।
জৈবযৌগের বৈশিষ্ট :
1) জৈব যৌগের অণুতে কার্বন পরমাণু অবশ্যই থাকবে ।
2) জৈবযৌগ গুলি প্রধানত সম যোজী ।
3)এদের গলনাঙ্ক, স্ফুটনাঙ্ক কম হয় । বেশিরভাগই উদ্বায়ী ।
4) জৈব যৌগ গুলি জলে অদ্রবণীয় ,কিন্তূ জৈব দ্রাবকে (এলকোহল ,বেঞ্জিন ) দ্রবণীয় ।
5) এগুলি তড়িৎ বিশ্লেষ্য নয় । গলিত বা দ্রবীভূত অবস্থায় তড়িৎ পরিবহন করে না ।
6) জৈব যৌগ গুলির মধ্যে রাসায়নিক বিক্রিয়া মন্থর গতিতে হয় ।
7) প্রায় সমস্ত জৈব যৌগ দাহ্য ।
অজৈব যৌগের বৈশিষ্ট :
1) অজৈব যৌগ গুলির মধ্যে কার্বনের মতো নিৰ্দিষ্ট কোনো মৌলের উপস্থিতি দেখা যায় না ।
2) অজৈব যৌগ গুলির মধ্যে সাধারণত আয়োনীয় যোজ্যতা দেখা যায় ।
3) এদের গলনাঙ্ক ,স্ফুটনাঙ্ক বেশি ।
4) এগুলি জলে দ্রাব্য হয় । জৈব দ্রাবকে অদ্রবণীয় হয় ।
৫) এগুলি তড়িৎ বিশ্লেষ্য ,এদের জলীয় দ্রবণ তড়িৎ পরিবহণ করে ।
6) এদের মধ্যে রাসায়নিক বিক্রিয়া দ্রুতগতিতে হয় ।
7) বেশির ভাগ অজৈব যৌগ অদাহ্য ।
কার্বনের চতুর্যোজ্যতা :

কার্বনের পরমাণু ক্রমাঙ্ক 6 |এর ইলেকট্রন বিন্যাস হল 2.4 |সর্ব বহিঃস্ত কক্ষে 4 টি ইলেকট্রন থাকে । বাহিরের এই চার টি ইলেকট্রন অন্য পরমাণুর চারটি ইলেকট্রনের সঙ্গে চারজোড়া ইলেকট্রন গঠন করে সম যোজ্যতায় যুক্ত হয়ে জৈব যৌগ গঠন করে । এই জন্য কার্বনের যোজ্যতা সব্সময় 4 হয় ।

কার্বনের চারটি যোজ্যতা এক সমতলে থাকে না । একটি চতুস্তলকের কেন্দ্রে কার্বন পরমাণু অবস্থান করে । চারটি যোজ্যতা চতুস্তলকটির চারটি শীর্ষ বিন্দুর দিকে প্রসারিত । যেকোনো দুটি যোজ্যতার মধ্যবর্তী কোণের পরিমান প্রায় 109.5⁰ |
মিথেনের গঠন (CH₄) : এখানে একটি কার্বণ পরমাণু চারটি হাইড্রোজেন পরমাণুর সঙ্গে এক বন্ধন দ্বারা সম যোজ্যতায় যুক্ত থাকে ।

কার্বন পরমাণুর ক্যাটিনেশন ধর্ম :
কার্বন পারমাণুগুলি পরস্পরের সঙ্গে একবন্ধন (ー),দ্বিবন্ধন (=) বা ত্রিবন্ধন (☰) দ্বারা যুক্ত হয়ে লম্বা কার্বন শৃঙ্খল ( মুক্ত অথবা বদ্ধ ) গঠন করতে পারে । কার্বন পরমাণুর এই ধর্মকে ক্যাটিনেশন ধৰ্ম বলে ।

হাইড্রোকার্বন :কার্বন ও হাইড্রোজেন দ্বারা গঠিত জৈব যৌগকে হাইড্রো কার্বন বলে ।যেমন - মিথেন (CH₄), ইথেন (C₂H₆) ,ইথিলিন (C₂H₄)ও এসিটিলিন (C₂H₂) ইত্যাদি ।
হাইড্রোকার্বনের শ্রেণীবিভাগ : হাইড্রোকার্বন দুই প্রকারের হয় । 1) সম্পৃক্ত হাইড্রোকার্বন ( Saturated Hydrocarbon) 2) অসম্পৃক্ত হাইড্রোকার্বন (Unsaturated Hydrocarbon)
1)সম্পৃক্ত হাইড্রোকার্বন বা এলকেন :যে হাইড্রোকার্বনে কার্বণ পারমাণুগুলি পরস্পরের সঙ্গে এক বন্ধন দ্বারা যুক্ত থাকে তাকে সম্পৃক্ত হাইড্রোকার্বন বা এলকেন বলে ।যেমন -ইথেন (C₂H₆) ,প্রোপেন (C₃H₈) ,বিউটেন (C₄H₁₀) ইত্যাদি । সম্পৃক্ত হাইড্রোকার্বনের সাধারণ সংকেত CnH₂n₊₂ , যেখানে n = 1,2,3,4 ইত্যাদি ।


ইথেন প্রোপেন
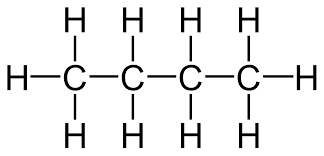
বিউটেন
2) অসম্পৃক্ত হাইড্রোকার্বন : যে সব হাইড্রোকার্বনের অণুতে কমপক্ষে দুটি কার্বণ পরমাণু পরস্পরের সঙ্গে সমযোজ্যতায় দ্বি বন্ধন বা ত্রিবন্ধন দ্বারা যুক্ত থাকে তাদের অসম্পৃক্ত হাইড্রোকার্বন বলে ।অসম্পৃক্ত হাইড্রোকার্বোন দুই প্রকারের হয় । i) এলকিন (Alkene) ii) এলকাইন (Alkyne )
i) এলকিন (Alkene): দ্বিবন্ধন যুক্ত অসম্পৃক্ত হাইড্রোকার্বনকে এলকিন বলে । এলকিনের সাধারণ সংকেত হয় CnH₂n যেখানে n = 2,3,4 ইত্যাদি ।যেমন - ইথিলিন( C₂H₄), এখানে n = 2 |

ii) এলকাইন (Alkyne ) ত্রিবন্ধন যুক্ত অসম্পৃক্ত হাইড্রোকার্বনকে এলকাইন বলে । এদের সাধারণ সংকেত CnH₂n₋₂ যেখানে n = 2,3 4 ইত্যাদি পূর্ণ সংখ্যা । যেমন -এসিটিলিন (C₂H₂)

হাইড্রোকার্বন মূলক বা জৈব মূলক : হাইড্রোকার্বন থেকে এক বা একাধিক হাইড্রোজেন পরমাণু অপসারিত হয়ে কার্বন ও হাইড্রোজেনের যে পরমাণু জোট পাওয়া যায় যা রাসায়নিক বিক্রিয়ায় সাধারণত অপরিবর্তিত থাকে তাকে হাইড্রোকার্বন মূলক বা জৈব মূলক বলে ।যেমন - মিথেন(CH₄ ) থেকে মিথাইল মূলক ( 一CH₃) ,ইথেন থেকে ইথাইল (一C₂H₅) ইত্যাদি ।


মিথাইল গ্রুপ ইথাইল গ্রুপ
কার্যকরী মূলক ( Functional groups) :
যে সমস্ত সক্রিয় পরমাণু বা পরমাণু পুঞ্জ জৈব যৌগের অণুতে উপস্থিত থেকে যৌগের প্রকৃতি ,ধৰ্ম এবং রাসায়নিক বিশিষ্টতা নির্ধারণ করে তাদের কার্যকরী মূলক বলে । নিচে কয়েকটি কার্য্যকরী মূলকের নাম ও পরিচিতি দেওয়া হল ।
1) হাইড্রক্সিল মূলক ( ₋OH) : যে সকল জৈব যৌগে এই মূলক থাকে তাদের এলকোহল বলে । যেমন মিথাইল এলকোহল (CH₃OH ) ,ইথাইল এলকোহল (C₂H₅OH)|
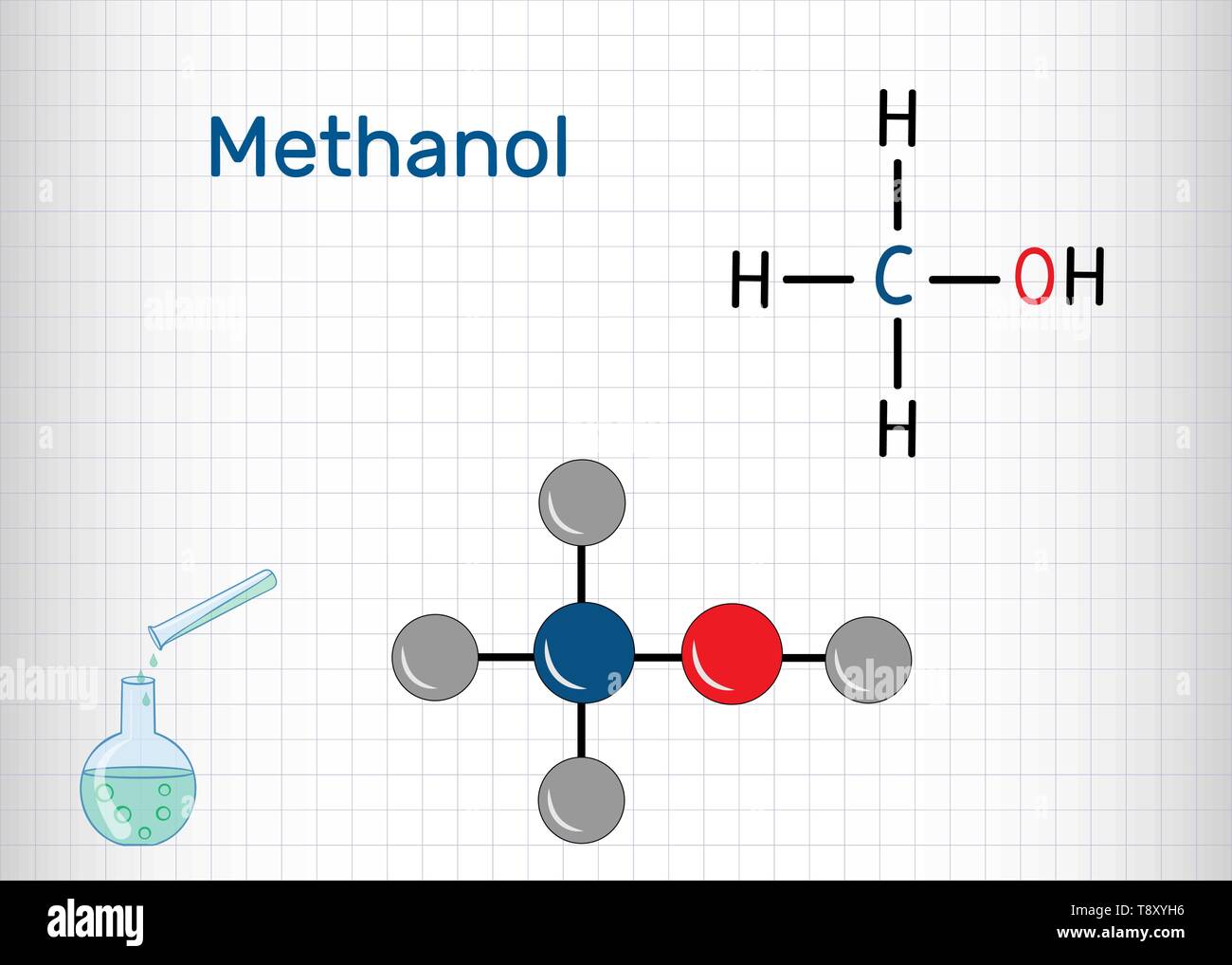
মিথাইল এলকোহল
ইথাইল এলকোহল
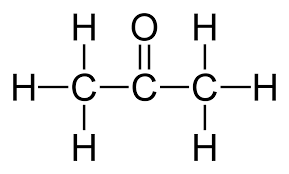
2) এলডিহাইড মূলক ( ーCHO)

এলডিহাইড মূলকের গঠন সংকেত
যে সমস্ত জৈব যৌগে এলডিহাইড মূলক থাকে তাদের এলডিহাইড যৌগ বলে । যেমন এসিটেলডিহাইড (CH₃CHO )
 বা
বা 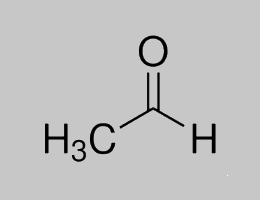
এসিটেলডিহাইডএর গঠন সংকেত ।
কিটো মূলক (ーCO ) :
কিটোন মূলকের গঠন সংকেত
যে সকল জৈব যৌগে কিটোন মূলকটি থাকে তাদের কিটোন জাতীয় যৌগ বলে । যেমন - এসিটোন ( CH₃COCH₃)
এসিটোনের গঠন সংকেত -
4) কার্বক্সিল মূলক (一COOH ) :
এই মূলকের গঠন সংকেত -

এই মূলকটি বর্তমান থাকলে যৌগটি জৈব এসিড বা কার্বক্সিলিক এসিড হয় । যেমন - এসিটিক এসিড (CH₃COOH) ও ফরমিক এসিড (HCOOH) |
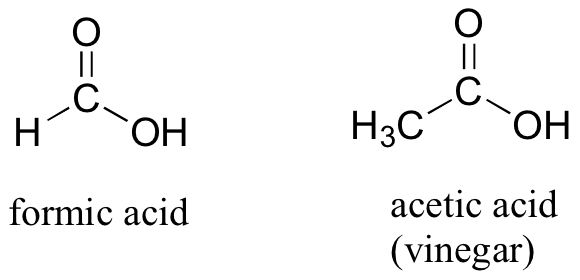
5) এমিন মূলক ( ーNH₂ ) :
এমিন মূলকের গঠন সংকেত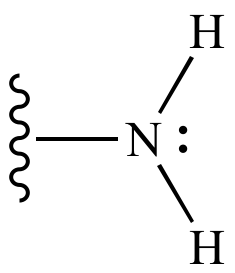
যৌগ গুলিকে বলা হয় এমিন যৌগ ।যেমন - মিথাইল এমিন (CH₃NH₂)
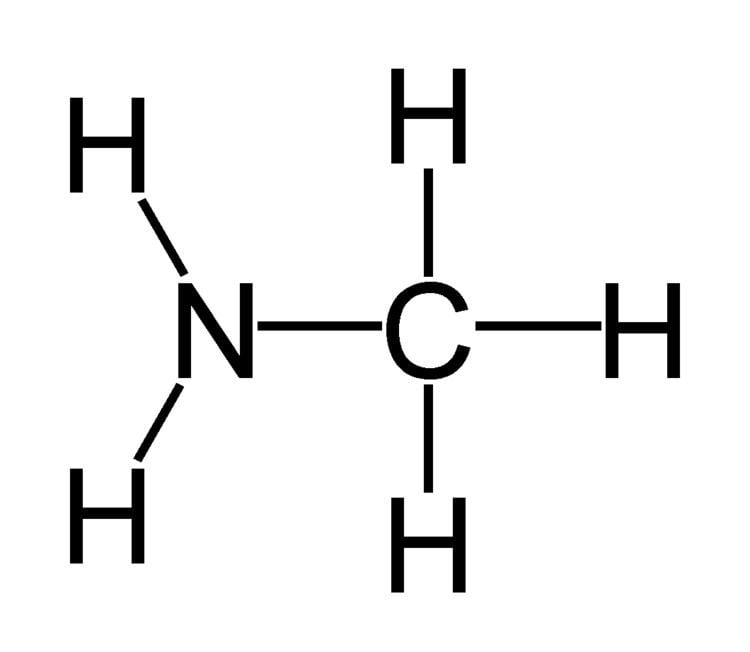 বা
বা 
মিথাইল এমিন এর গঠন সংকেত।
6) ইথার বা এলকোক্সি মূলক ( ーOー ):
এইমূলক উপস্থিত থাকলে যৌগ গুলিকে ইথার যৌগ বলা হয় । যেমন ডাইমিথাইল ইথার (CH₃OCH₃)

বা

সমা বয়তা ( Isomerism):
জৈব যৌগের যে বৈশিষ্টের জন্য একই আনবিক সংকেতের সাহায্যে ভিন্ন ভিন্ন আনবিক গঠন ও ধর্মাবলম্বী জৈব যৌগকে প্রকাশ করা যায় তাকে সমাবয়তা বলে । এই ভাবে প্রাপ্ত ভিন্ন ভিন্ন জৈব যৌগগুলিকে পরস্পরের সমাবয়ব (Isomer) বলে ।
সমা বয়তা দুই প্রকারের হয় - 1) গঠনমূলক সমা বয়তা 2) ত্রিমাত্রিক সমা বয়তা
1) গঠনমূলক সমা বয়তা : জৈবযৌগে পরমাণুসমূহের আনবিক গঠনের ভিন্নতার জন্য যে সমা বয়তা দেখা যায় তাকে গঠনমূলক সমা বয়তা বলে । গঠনমূলক সমা বয়তা আবার দুই প্রকারের -
a) কার্যকরী মূলক ঘটিত সমা বয়তা : জৈব যৌগে কার্যকরী মূলকের পার্থক্যের জন্য যে সমা বয়তা র সৃষ্টি হয় তাকে কার্যকরি মূলক ঘটিত সমা বয়তা বলে ।যেমন -CH₃CH₂OH( কার্যকরী মূলক - OH), এবং
CH₃OCH₃(কার্যকরি মূলক 一O一) | ₃প্রত্যেকের আনবিক সংকেত C₂H₆O) |
প্রথম জৈব যৌগ টি এলকোহল দ্বিতীয় যৌগটি হল ইথার । এই দুটি যৌগের সম্পূর্ণ আলাদা ।
b) অবস্থান ঘটিত সমাবয়তা :এই ধরনের সমাবয়তায় কার্যকরী মূলকের অবস্থানের পার্থক্য দেখা যায় । যেমন - CH₃CH₂CH₂OH এবং CH₃CHOHCH₃ | এদের প্রতেকের আনবিক সংকেত C₃H₈O |এখানে দুটিই এলকোহল । কিন্তূ দুটি ভিন্ন ধরনের এলকোহল । প্রথমটি প্রোপাইল এলকোহল । দ্বিতীয় টি আইসো প্রোপাইল এলকোহল ।


জৈব যৌগ -
কার্বনের অক্সাইড ,ধাতব কার্বনেট ও বাইকার্বোনেট ,ধাতব সায়ানাইড এবং হাইড্রোজেন সায়ানাইড বাদে কার্বন দ্বারা গঠিত যে যৌগ গুলির মধ্যে কার্বনের ক্যাটিনেশন ধৰ্ম ,সমবয়তা বৈশিষ্ট দেখা যায় তাদের জৈব যৌগ বলে ।

জৈব রসায়ন:
জৈব যৌগের রসায়ন কে জৈব রসায়ন বলে ।
জৈবযৌগের বৈশিষ্ট :
1) জৈব যৌগের অণুতে কার্বন পরমাণু অবশ্যই থাকবে ।
2) জৈবযৌগ গুলি প্রধানত সম যোজী ।
3)এদের গলনাঙ্ক, স্ফুটনাঙ্ক কম হয় । বেশিরভাগই উদ্বায়ী ।
4) জৈব যৌগ গুলি জলে অদ্রবণীয় ,কিন্তূ জৈব দ্রাবকে (এলকোহল ,বেঞ্জিন ) দ্রবণীয় ।
5) এগুলি তড়িৎ বিশ্লেষ্য নয় । গলিত বা দ্রবীভূত অবস্থায় তড়িৎ পরিবহন করে না ।
6) জৈব যৌগ গুলির মধ্যে রাসায়নিক বিক্রিয়া মন্থর গতিতে হয় ।
7) প্রায় সমস্ত জৈব যৌগ দাহ্য ।
অজৈব যৌগের বৈশিষ্ট :
1) অজৈব যৌগ গুলির মধ্যে কার্বনের মতো নিৰ্দিষ্ট কোনো মৌলের উপস্থিতি দেখা যায় না ।
2) অজৈব যৌগ গুলির মধ্যে সাধারণত আয়োনীয় যোজ্যতা দেখা যায় ।
3) এদের গলনাঙ্ক ,স্ফুটনাঙ্ক বেশি ।
4) এগুলি জলে দ্রাব্য হয় । জৈব দ্রাবকে অদ্রবণীয় হয় ।
৫) এগুলি তড়িৎ বিশ্লেষ্য ,এদের জলীয় দ্রবণ তড়িৎ পরিবহণ করে ।
6) এদের মধ্যে রাসায়নিক বিক্রিয়া দ্রুতগতিতে হয় ।
7) বেশির ভাগ অজৈব যৌগ অদাহ্য ।
কার্বনের চতুর্যোজ্যতা :
কার্বনের পরমাণু ক্রমাঙ্ক 6 |এর ইলেকট্রন বিন্যাস হল 2.4 |সর্ব বহিঃস্ত কক্ষে 4 টি ইলেকট্রন থাকে । বাহিরের এই চার টি ইলেকট্রন অন্য পরমাণুর চারটি ইলেকট্রনের সঙ্গে চারজোড়া ইলেকট্রন গঠন করে সম যোজ্যতায় যুক্ত হয়ে জৈব যৌগ গঠন করে । এই জন্য কার্বনের যোজ্যতা সব্সময় 4 হয় ।

কার্বনের চারটি যোজ্যতা এক সমতলে থাকে না । একটি চতুস্তলকের কেন্দ্রে কার্বন পরমাণু অবস্থান করে । চারটি যোজ্যতা চতুস্তলকটির চারটি শীর্ষ বিন্দুর দিকে প্রসারিত । যেকোনো দুটি যোজ্যতার মধ্যবর্তী কোণের পরিমান প্রায় 109.5⁰ |
মিথেনের গঠন (CH₄) : এখানে একটি কার্বণ পরমাণু চারটি হাইড্রোজেন পরমাণুর সঙ্গে এক বন্ধন দ্বারা সম যোজ্যতায় যুক্ত থাকে ।
কার্বন পরমাণুর ক্যাটিনেশন ধর্ম :
কার্বন পারমাণুগুলি পরস্পরের সঙ্গে একবন্ধন (ー),দ্বিবন্ধন (=) বা ত্রিবন্ধন (☰) দ্বারা যুক্ত হয়ে লম্বা কার্বন শৃঙ্খল ( মুক্ত অথবা বদ্ধ ) গঠন করতে পারে । কার্বন পরমাণুর এই ধর্মকে ক্যাটিনেশন ধৰ্ম বলে ।
হাইড্রোকার্বন :কার্বন ও হাইড্রোজেন দ্বারা গঠিত জৈব যৌগকে হাইড্রো কার্বন বলে ।যেমন - মিথেন (CH₄), ইথেন (C₂H₆) ,ইথিলিন (C₂H₄)ও এসিটিলিন (C₂H₂) ইত্যাদি ।
হাইড্রোকার্বনের শ্রেণীবিভাগ : হাইড্রোকার্বন দুই প্রকারের হয় । 1) সম্পৃক্ত হাইড্রোকার্বন ( Saturated Hydrocarbon) 2) অসম্পৃক্ত হাইড্রোকার্বন (Unsaturated Hydrocarbon)
1)সম্পৃক্ত হাইড্রোকার্বন বা এলকেন :যে হাইড্রোকার্বনে কার্বণ পারমাণুগুলি পরস্পরের সঙ্গে এক বন্ধন দ্বারা যুক্ত থাকে তাকে সম্পৃক্ত হাইড্রোকার্বন বা এলকেন বলে ।যেমন -ইথেন (C₂H₆) ,প্রোপেন (C₃H₈) ,বিউটেন (C₄H₁₀) ইত্যাদি । সম্পৃক্ত হাইড্রোকার্বনের সাধারণ সংকেত CnH₂n₊₂ , যেখানে n = 1,2,3,4 ইত্যাদি ।
ইথেন প্রোপেন
বিউটেন
2) অসম্পৃক্ত হাইড্রোকার্বন : যে সব হাইড্রোকার্বনের অণুতে কমপক্ষে দুটি কার্বণ পরমাণু পরস্পরের সঙ্গে সমযোজ্যতায় দ্বি বন্ধন বা ত্রিবন্ধন দ্বারা যুক্ত থাকে তাদের অসম্পৃক্ত হাইড্রোকার্বন বলে ।অসম্পৃক্ত হাইড্রোকার্বোন দুই প্রকারের হয় । i) এলকিন (Alkene) ii) এলকাইন (Alkyne )
i) এলকিন (Alkene): দ্বিবন্ধন যুক্ত অসম্পৃক্ত হাইড্রোকার্বনকে এলকিন বলে । এলকিনের সাধারণ সংকেত হয় CnH₂n যেখানে n = 2,3,4 ইত্যাদি ।যেমন - ইথিলিন( C₂H₄), এখানে n = 2 |

ii) এলকাইন (Alkyne ) ত্রিবন্ধন যুক্ত অসম্পৃক্ত হাইড্রোকার্বনকে এলকাইন বলে । এদের সাধারণ সংকেত CnH₂n₋₂ যেখানে n = 2,3 4 ইত্যাদি পূর্ণ সংখ্যা । যেমন -এসিটিলিন (C₂H₂)
হাইড্রোকার্বন মূলক বা জৈব মূলক : হাইড্রোকার্বন থেকে এক বা একাধিক হাইড্রোজেন পরমাণু অপসারিত হয়ে কার্বন ও হাইড্রোজেনের যে পরমাণু জোট পাওয়া যায় যা রাসায়নিক বিক্রিয়ায় সাধারণত অপরিবর্তিত থাকে তাকে হাইড্রোকার্বন মূলক বা জৈব মূলক বলে ।যেমন - মিথেন(CH₄ ) থেকে মিথাইল মূলক ( 一CH₃) ,ইথেন থেকে ইথাইল (一C₂H₅) ইত্যাদি ।
মিথাইল গ্রুপ ইথাইল গ্রুপ
কার্যকরী মূলক ( Functional groups) :
যে সমস্ত সক্রিয় পরমাণু বা পরমাণু পুঞ্জ জৈব যৌগের অণুতে উপস্থিত থেকে যৌগের প্রকৃতি ,ধৰ্ম এবং রাসায়নিক বিশিষ্টতা নির্ধারণ করে তাদের কার্যকরী মূলক বলে । নিচে কয়েকটি কার্য্যকরী মূলকের নাম ও পরিচিতি দেওয়া হল ।
1) হাইড্রক্সিল মূলক ( ₋OH) : যে সকল জৈব যৌগে এই মূলক থাকে তাদের এলকোহল বলে । যেমন মিথাইল এলকোহল (CH₃OH ) ,ইথাইল এলকোহল (C₂H₅OH)|

মিথাইল এলকোহল
ইথাইল এলকোহল
2) এলডিহাইড মূলক ( ーCHO)

এলডিহাইড মূলকের গঠন সংকেত
যে সমস্ত জৈব যৌগে এলডিহাইড মূলক থাকে তাদের এলডিহাইড যৌগ বলে । যেমন এসিটেলডিহাইড (CH₃CHO )
 বা
বা 
এসিটেলডিহাইডএর গঠন সংকেত ।
কিটো মূলক (ーCO ) :
কিটোন মূলকের গঠন সংকেত
যে সকল জৈব যৌগে কিটোন মূলকটি থাকে তাদের কিটোন জাতীয় যৌগ বলে । যেমন - এসিটোন ( CH₃COCH₃)
এসিটোনের গঠন সংকেত -

4) কার্বক্সিল মূলক (一COOH ) :
এই মূলকের গঠন সংকেত -

এই মূলকটি বর্তমান থাকলে যৌগটি জৈব এসিড বা কার্বক্সিলিক এসিড হয় । যেমন - এসিটিক এসিড (CH₃COOH) ও ফরমিক এসিড (HCOOH) |

5) এমিন মূলক ( ーNH₂ ) :
এমিন মূলকের গঠন সংকেত

যৌগ গুলিকে বলা হয় এমিন যৌগ ।যেমন - মিথাইল এমিন (CH₃NH₂)
 বা
বা মিথাইল এমিন এর গঠন সংকেত।
6) ইথার বা এলকোক্সি মূলক ( ーOー ):
এইমূলক উপস্থিত থাকলে যৌগ গুলিকে ইথার যৌগ বলা হয় । যেমন ডাইমিথাইল ইথার (CH₃OCH₃)

বা

সমা বয়তা ( Isomerism):
জৈব যৌগের যে বৈশিষ্টের জন্য একই আনবিক সংকেতের সাহায্যে ভিন্ন ভিন্ন আনবিক গঠন ও ধর্মাবলম্বী জৈব যৌগকে প্রকাশ করা যায় তাকে সমাবয়তা বলে । এই ভাবে প্রাপ্ত ভিন্ন ভিন্ন জৈব যৌগগুলিকে পরস্পরের সমাবয়ব (Isomer) বলে ।
সমা বয়তা দুই প্রকারের হয় - 1) গঠনমূলক সমা বয়তা 2) ত্রিমাত্রিক সমা বয়তা
1) গঠনমূলক সমা বয়তা : জৈবযৌগে পরমাণুসমূহের আনবিক গঠনের ভিন্নতার জন্য যে সমা বয়তা দেখা যায় তাকে গঠনমূলক সমা বয়তা বলে । গঠনমূলক সমা বয়তা আবার দুই প্রকারের -
a) কার্যকরী মূলক ঘটিত সমা বয়তা : জৈব যৌগে কার্যকরী মূলকের পার্থক্যের জন্য যে সমা বয়তা র সৃষ্টি হয় তাকে কার্যকরি মূলক ঘটিত সমা বয়তা বলে ।যেমন -CH₃CH₂OH( কার্যকরী মূলক - OH), এবং
CH₃OCH₃(কার্যকরি মূলক 一O一) | ₃প্রত্যেকের আনবিক সংকেত C₂H₆O) |
প্রথম জৈব যৌগ টি এলকোহল দ্বিতীয় যৌগটি হল ইথার । এই দুটি যৌগের সম্পূর্ণ আলাদা ।
b) অবস্থান ঘটিত সমাবয়তা :এই ধরনের সমাবয়তায় কার্যকরী মূলকের অবস্থানের পার্থক্য দেখা যায় । যেমন - CH₃CH₂CH₂OH এবং CH₃CHOHCH₃ | এদের প্রতেকের আনবিক সংকেত C₃H₈O |এখানে দুটিই এলকোহল । কিন্তূ দুটি ভিন্ন ধরনের এলকোহল । প্রথমটি প্রোপাইল এলকোহল । দ্বিতীয় টি আইসো প্রোপাইল এলকোহল ।


বহু বিকল্প ভিত্তিক প্রশ্নাবলী (MCQ) :
1. নীচের কোনটি একটি সম্পৃক্ত হাইড্রোকার্বন ?
A) C₃H₆ B) C₂H₄ C) C₂H₂ D) C₂H₆
2. ইথাইল এলকোহল এর কার্যকরী মূলক হল
A) ーOH B) ーCHO C) >C=O D) 一COOH
3.নীচের কোনটি দুটি কার্বন পরমাণু যুক্ত এলকিল গ্রুপ ?
A) মিথাইল B) ইথাইল C) প্রোপাইল D) আইসোপ্রোপাইল
4.সম যোজী দ্বিবন্ধন যুক্ত একটি জৈব যৌগ হল
A) মিথেন B) ইথেন C) ইথিলিন D) এসিটিলিন
5. LPG এর প্রধান উপাদান হল
A) বিউটেন B) প্রোপেন C) ইথেন D) এসিটিলিন
6. বায়ুতে মিথেনের দহনের ফলে উৎপন্ন হয়
A) কার্বন মনোক্সাইড B) কার্বন ডাই অক্সাইড C) ইথিলিন D) ইথেন
7.একটি জৈব ভঙ্গুর পলিমার হল
A) পলিথিন B) পিভিসি C) টেফলন D) স্টার্চ
8.বার্ণিশের কাজে ব্যবহৃত হয়
A) মিথেন B) ইথাইল এলকোহল C) ডিনেচার্ড স্পিরিট D) ইথিলিন
9.নিচের কোনটি এলডিহাইডের কার্যকরী গ্রুপ ?
A) ーOH B) ーCHO C) >C = O D) ーCOOH
10.কোনটি সম্পৃক্ত হাইড্রোকার্বোন নয়
A) CH₄ B) C₂H₆ C) C₂H₄ D) C₃H₈



কোন মন্তব্য নেই:
একটি মন্তব্য পোস্ট করুন