আয়োনীয় ও সমযোজী বন্ধন (Ionic and Covalent Bonding)
তড়িৎ যোজ্যতা (Electro Valency):
নিকটতম নিষ্ক্রিয় গ্যাসের মতো সুস্থিত ইলেকট্রন কাঠামো লাভের চেষ্টায় কোনো পরমাণু অন্য আর একটি পরমাণুর সঙ্গে তার বাহিরের কক্ষে ইলেকট্রন বর্জন ও গ্রহণের মাধ্যমে ধনাত্মক ও ঋণাত্মক আয়ন এ পরিণত হয় এবং এই বিপরীত তড়িৎ আয়ন গুলি পরস্পর স্থির তড়িৎ আকর্ষণের দ্বারা যুক্ত হয়ে যৌগ গঠন করে । এই ভাবে ইলেকট্রন গ্রহণ ও বর্জনের মাধ্যমে যৌগ গঠনের ক্ষমতাকে তড়িৎ যোজ্যতা বলে ।
তড়িৎ যোজী বন্ধন :
তড়িৎ যোজ্যতার দ্বারা যৌগ গঠনের সময় পরমাণু গুলির মধ্যে যে রাসায়নিক বন্ধন সৃষ্টি হয় তাকে তড়িৎ যোজী বন্ধন বলে । তড়িৎ যোজ্যতার সাহায্যে যৌগ গঠনের সময় একটি পরমাণু যতগুলি ইলেকট্রন গ্রহণ বা বর্জন করে সেই সংখ্যাই হল মৌলটির তড়িৎ যোজ্যতার পরিমাপ ।
উদাহরণ :
সোডিয়াম ক্লোরাইড এর গঠন (NaCl ) :


সোডিয়াম পরমাণুর ইলেকট্রন কাঠামো হল 2,8,1 এবং ক্লোরিন পরমাণুর ইলেকট্রন কাঠামো হল 2,8,7 | সোডিয়াম পরমাণু তার বাহিরের কক্ষের ইলেকট্রনটি ক্লোরিন পরমাণুকে দান করে । ফলে সোডিয়াম পরমাণু ধনাত্মক আয়ন হয় এবং ক্লোরিন পরমাণু ঋণাত্মক আয়ন হয় ।
Na - e = Na⁺, Cl + e = Cl⁻
Na⁺ + Cl ⁻ = NaCl
এখানে Na এর যোজ্যতা = 1, Cl এর যোজ্যতা =1 |
ক্যালসিয়াম অক্সাইডের (CaO) গঠন :

ক্যালসিয়াম পরমাণুর ইলেকট্রন কাঠামো হল 2,8,8,2 | অক্সিজেনের ইলেকট্রন কাঠামো হল 2,6 | ক্যালসিয়াম পরমাণু বাহিরের কক্ষের 2 ইলেকট্রন অক্সিজেনকে দান করে । ক্যালসিয়াম ধনাত্মক আয়ন গঠন করে । অক্সিজেন ঋণাত্মক আয়ন গঠন করে ।
Ca ⟶ Ca ²⁺ + 2e ,O + 2e ⟶O²⁻
Ca ²⁺ + O²⁻ ➝ CaO
ম্যাগনেশিয়াম ক্লোরাইড (MgCl₂) এর গঠন :

ম্যাগনেসিয়ামের ইলেকট্রন কাঠামো - 2,8,2 | ক্লোরিনের ইলেকট্রন বিন্যাস - 2,8,7 | ম্যাগনেসিয়াম তার দুটি বাহিরের কক্ষের ইলেকট্রন দুটি ক্লোরিন পরমাণুকে প্রদান করে । ম্যাগনেসিয়াম ধনাত্মক আয়ন এবং ক্লোরিন ঋণাত্মক তৈরি করে ।
Mg ➝ Mg²⁺ + 2e ; 2Cl + 2e ⟶ 2Cl⁻
Mg²⁺ +2Cl⁻ ⟶ MgCl₂
তড়িৎ যোজি যৌগ (Ionic Compound) :
যে সকল যৌগের মধ্যে উপস্থিত মৌলগুলি তড়িৎ যোজ্যতায় যুক্ত থাকে সেই সকল যৌগকে তড়িৎ যোজি যৌগ বলে ।যেমন NaCl ,CaO, MgCl₂, Al₂O₃ ইত্যাদি ।
তড়িৎযোজি যৌগের বৈশিষ্ট (Properties of ionic compound):
1) ভৌত অবস্থা : ধনাত্মক ও ঋণাত্মক আয়নের সমষ্টি হওয়ায় আয়ন গুলির মধ্যে তীব্র আকর্ষণ বল ক্রিয়া করে এবং আয়নগুলি ত্রিমাত্রিক ভাবে নিৰ্দিষ্ট জ্যামেতিক আকৃতিতে সজ্জিত হয় । সাধারণ চাপে ও উস্নতায় কঠিন অবস্থায় থাকে ।
2) গলনাঙ্ক : বিপরীত ধর্মী আয়ন গুলির মধ্যে তীব্র আকর্ষণ কাজ করায় গলনাঙ্ক উচ্চ হয় ।
3) কাঠিন্য : পদার্থ গুলি কেলাসাকার হয় । বাহিরের থেকে বল প্রয়োগের দ্বারা আঘাত করলে সমধর্মী আয়ন গুলি পরস্পর কাছাকাছি চলে আসে ।ফলে সমধর্মী আয়ন গুলির মধ্যে বিকর্ষণ তীব্রতর হয় এবং কেলাস ভেঙে যায় ।
4)তড়িৎ পরিবাহিতা : কঠিন অবস্থায় বিপরীত ধর্মী আয়ন গুলি নিৰ্দিষ্ট স্থান বজায় রেখে তীব্র স্থির তড়িৎ আকর্ষণ দ্বারা শক্ত ভাবে আবদ্ধ থাকে । ফলে তড়িতের অপরিবাহী হয় । কিন্তূ গলিত বা জলে দ্রবীভূত অবস্থায় আয়ন গুলি মুক্ত হয়ে যায় । ফলে তড়িতের সুপারিবাহী হয় ।
5) দ্রাবত্যা : আয়োনীয় যৌগ গুলি ধ্রুবিও দ্রাবক ( যেমন -জল ) দ্রাব্য ,কিন্তূ অধ্রুবীয় দ্রাবকে ( বেনজিন , কেরোসিনে ) অদ্রাব্য ।
সমযোজী বন্ধন (Covalent bonding):
নিকটতম নিষ্ক্রিয় গ্যাসের পরমাণুর মত সুস্থিত ইলেকট্রন বিন্যাস লাভের জন্য যখন দুটি পরমাণু এক বা একাধিক ইলেকট্রন জোড় সমভাবে ব্যবহার করে বাহিরের কক্ষকে আটটি এবং হাইড্রোজেনের ক্ষেত্রে দুটি ইলেকট্রন সংখ্যা পূর্ণ করে যৌগের অণু গঠন করে তখন এইরূপ অণু গঠন করার ক্ষমতাকে সম যোজ্যতা বলে ।
সম যোজ্যতা গঠনের সময় একটি পরমাণু যত গুলি ইলেকট্রন জোড় গঠন করে সেই সংখ্যাটি হল সম যোজ্যতার পরিমাপ ।
সম যোজ্যতার প্রকার ভেদ :
সম যোজি বন্ধন তিন প্রকারের হয় । দুটি পরমাণুর মধ্যে একটি ইলেকট্রন জোড় গঠিত হলে বন্ধনটিকে এক বন্ধন বলে । একে '一' চিহ্ন দ্বারা প্রকাশ করা হয় ।দুটি পরমাণুর মধ্যে দুটি ইলেকট্রন জোড় গঠিত হলে দ্বিবন্ধন গঠিত হয় । একে'=' চিহ্ন দ্বারা প্রকাশ করা হয় । দুটি পরমাণুর মধ্যে তিনটি ইলেকট্রন জোড় গঠিত হলে ত্রিবন্ধন তৈরি হয় । একে'☰'চিহ্ন দ্বারা লেখা হয় ।
হাইড্রোজেন অনুর গঠন (H₂):

অনু গঠনের সময় প্রত্যেক টি হাইড্রোজেন পরমাণু একটি করে ইলেকট্রন দিয়ে এক জোড়া ইলেকট্রন গঠন করে এবং ওই ইলেকট্রন জোড় উভয় পরমাণু সমভাবে ব্যবহার করে । H₂ অণু তৈরি হয় ।
হাইড্রোজেন ক্লোরাইড (HCl) এর অণুর গঠন :

হাইড্রোজেন পরমাণু একটি ইলেকট্রন ও ক্লোরিন পরমাণু একটি ইলেকট্রন দিয়ে এক জোড়া ইলেকট্রন গঠন করে ।এই ইলেকট্রন জোড়কে উভয় পরমাণু সমভাবে ব্যবহার করে । হাইড্রোজেন পরমাণু বাহিরের কক্ষে 2 টি ইলেকট্রন ( নিষ্ক্রিয় মৌল He এর কাঠামো ) এবং ক্লোরিন পরমাণু তার বাহিরের কক্ষে 8 টি ইলেক্ট্রন ( He বাদে অন্য নিষ্ক্রিয় মৌলের ইলেকট্রন কাঠামো ) লাভ করে ।
জলের অণুর গঠন (H ₂O ) :


এখানে দুটি হাইড্রোজেন পরমাণুর প্রত্যেকটি একটি করে ইলেকট্রন দান করে দুই জোড়া ইলেকট্রন গঠন করে । এই দুই জোড়া ইলেকট্রন একটি অক্সিজেন পরমাণু ও দুটি হাইড্রোজেন পরমাণু সমভাবে ব্যবহার করে থাকে । বন্ধন গঠনের পরে অক্সিজেনের বাহিরের কক্ষে 8 টি এবং হাইড্রোজেনের বাহিরের কক্ষে 2 টি ইলেক্ট্রন হয় ।
মিথেন অণুর (CH₄) গঠন :


কার্বন পরমাণুর বাহিরের কক্ষে 4 টি ইলেকট্রন থাকে । এই চারটি ইলেকট্রন চারটি হাইড্রোজেন পরমাণুর ইলেকট্রনের সঙ্গে সমযোজী বন্ধন তৈরি করে ।
কার্বন ডাই অক্সাইড (CO₂) অণুর গঠন :
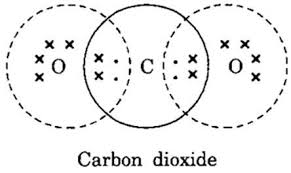

একটি কার্বন পরমাণু দুটি অক্সিজেন পরমাণুর প্রত্যেকটির সঙ্গে দুই জোড়া করে ইলেকট্রন জোড় গঠন করে ।ফলে প্রতিটি অক্সিজেন পরমাণু দুটি করে ইলেকট্রন জোড় এবং কার্বন পরমাণু 4 টি ইলেকট্রন জোড় সমভাবে ব্যবহার করে । কার্বন ও অক্সিজেন উভয় পরমাণুর বাহিরের কক্ষে 8 ইলেকট্রন সংখ্যা পূর্ণ হয় ।
নাইট্রোজেন (N₂) অণুর গঠন :

নাইট্রোজেনের বাহিরের কক্ষে 5 টি ইলেকট্রন থাকে । প্রতিটি পরমাণু 3 টি করে ইলেকট্রন দিয়ে 3 জোড় ইলেকট্রন গঠন করে যা উভয় পরমাণু সম ভাবে গ্রহণ করে তাদের বাহিরের কক্ষে 8 টি ইলেকট্রন পূর্ণ করে ।দুটি নাইট্রোজেন পরমাণু পরস্পর ত্রি বন্ধন দ্বারা যুক্ত হয় ।
সমযোজী যৌগের বৈশিষ্ট্য (Properties of covalent compounds):
1)ভৌত অবস্হা :সমযোজী যৌগের আয়নের কোনো অস্তিত্ত্ব নেই । অণুগুলির মধ্যে আকর্ষণ বল খুব কম । সেজন্য স্বাবাভিক চাপ ও উষ্নতায় সমযোজী যৌগ গুলি তরল ও গ্যাসীয় অথবা কোমল কঠিন হয় ।(যেমন মিথেন গ্যাসীয় ,ইথানল তরল এবং চিনি কঠিন )
2)গলনাঙ্ক ও স্ফুটনাঙ্ক : অণুগুলির মধ্যে আকর্ষণ বল কম হওয়ায় সমযোজী যৌগ গুলির গলনাঙ্ক ও স্ফুটনাঙ্ক আয়োনীয় যৌগের তুলনায় কম হয় ।
3)দ্রাব্যতা : সমযোজী যৌগ গুলি অধ্রুবীয় দ্রাবকে ( বেঞ্জিন ইত্যাদি ) দ্রবীভূত হয় । ধ্রুবীয়( জল )
দ্রাবকে দ্রবীভূত হয় না । )তড়িৎ পরিবাহিতা : যেহেতু সমযোজী যৌগ গুলি আয়নিত হয় না এগুলির জলীয় দ্রবণ তড়িৎ পরিবহন করে না ।
তড়িৎ যোজী বন্ধন :
তড়িৎ যোজ্যতার দ্বারা যৌগ গঠনের সময় পরমাণু গুলির মধ্যে যে রাসায়নিক বন্ধন সৃষ্টি হয় তাকে তড়িৎ যোজী বন্ধন বলে । তড়িৎ যোজ্যতার সাহায্যে যৌগ গঠনের সময় একটি পরমাণু যতগুলি ইলেকট্রন গ্রহণ বা বর্জন করে সেই সংখ্যাই হল মৌলটির তড়িৎ যোজ্যতার পরিমাপ ।
উদাহরণ :
সোডিয়াম ক্লোরাইড এর গঠন (NaCl ) :
সোডিয়াম পরমাণুর ইলেকট্রন কাঠামো হল 2,8,1 এবং ক্লোরিন পরমাণুর ইলেকট্রন কাঠামো হল 2,8,7 | সোডিয়াম পরমাণু তার বাহিরের কক্ষের ইলেকট্রনটি ক্লোরিন পরমাণুকে দান করে । ফলে সোডিয়াম পরমাণু ধনাত্মক আয়ন হয় এবং ক্লোরিন পরমাণু ঋণাত্মক আয়ন হয় ।
Na - e = Na⁺, Cl + e = Cl⁻
Na⁺ + Cl ⁻ = NaCl
এখানে Na এর যোজ্যতা = 1, Cl এর যোজ্যতা =1 |
ক্যালসিয়াম অক্সাইডের (CaO) গঠন :

ক্যালসিয়াম পরমাণুর ইলেকট্রন কাঠামো হল 2,8,8,2 | অক্সিজেনের ইলেকট্রন কাঠামো হল 2,6 | ক্যালসিয়াম পরমাণু বাহিরের কক্ষের 2 ইলেকট্রন অক্সিজেনকে দান করে । ক্যালসিয়াম ধনাত্মক আয়ন গঠন করে । অক্সিজেন ঋণাত্মক আয়ন গঠন করে ।
Ca ⟶ Ca ²⁺ + 2e ,O + 2e ⟶O²⁻
Ca ²⁺ + O²⁻ ➝ CaO
ম্যাগনেশিয়াম ক্লোরাইড (MgCl₂) এর গঠন :
ম্যাগনেসিয়ামের ইলেকট্রন কাঠামো - 2,8,2 | ক্লোরিনের ইলেকট্রন বিন্যাস - 2,8,7 | ম্যাগনেসিয়াম তার দুটি বাহিরের কক্ষের ইলেকট্রন দুটি ক্লোরিন পরমাণুকে প্রদান করে । ম্যাগনেসিয়াম ধনাত্মক আয়ন এবং ক্লোরিন ঋণাত্মক তৈরি করে ।
Mg ➝ Mg²⁺ + 2e ; 2Cl + 2e ⟶ 2Cl⁻
Mg²⁺ +2Cl⁻ ⟶ MgCl₂
তড়িৎ যোজি যৌগ (Ionic Compound) :
যে সকল যৌগের মধ্যে উপস্থিত মৌলগুলি তড়িৎ যোজ্যতায় যুক্ত থাকে সেই সকল যৌগকে তড়িৎ যোজি যৌগ বলে ।যেমন NaCl ,CaO, MgCl₂, Al₂O₃ ইত্যাদি ।
তড়িৎযোজি যৌগের বৈশিষ্ট (Properties of ionic compound):
1) ভৌত অবস্থা : ধনাত্মক ও ঋণাত্মক আয়নের সমষ্টি হওয়ায় আয়ন গুলির মধ্যে তীব্র আকর্ষণ বল ক্রিয়া করে এবং আয়নগুলি ত্রিমাত্রিক ভাবে নিৰ্দিষ্ট জ্যামেতিক আকৃতিতে সজ্জিত হয় । সাধারণ চাপে ও উস্নতায় কঠিন অবস্থায় থাকে ।
2) গলনাঙ্ক : বিপরীত ধর্মী আয়ন গুলির মধ্যে তীব্র আকর্ষণ কাজ করায় গলনাঙ্ক উচ্চ হয় ।
3) কাঠিন্য : পদার্থ গুলি কেলাসাকার হয় । বাহিরের থেকে বল প্রয়োগের দ্বারা আঘাত করলে সমধর্মী আয়ন গুলি পরস্পর কাছাকাছি চলে আসে ।ফলে সমধর্মী আয়ন গুলির মধ্যে বিকর্ষণ তীব্রতর হয় এবং কেলাস ভেঙে যায় ।
4)তড়িৎ পরিবাহিতা : কঠিন অবস্থায় বিপরীত ধর্মী আয়ন গুলি নিৰ্দিষ্ট স্থান বজায় রেখে তীব্র স্থির তড়িৎ আকর্ষণ দ্বারা শক্ত ভাবে আবদ্ধ থাকে । ফলে তড়িতের অপরিবাহী হয় । কিন্তূ গলিত বা জলে দ্রবীভূত অবস্থায় আয়ন গুলি মুক্ত হয়ে যায় । ফলে তড়িতের সুপারিবাহী হয় ।
5) দ্রাবত্যা : আয়োনীয় যৌগ গুলি ধ্রুবিও দ্রাবক ( যেমন -জল ) দ্রাব্য ,কিন্তূ অধ্রুবীয় দ্রাবকে ( বেনজিন , কেরোসিনে ) অদ্রাব্য ।
সমযোজী বন্ধন (Covalent bonding):
নিকটতম নিষ্ক্রিয় গ্যাসের পরমাণুর মত সুস্থিত ইলেকট্রন বিন্যাস লাভের জন্য যখন দুটি পরমাণু এক বা একাধিক ইলেকট্রন জোড় সমভাবে ব্যবহার করে বাহিরের কক্ষকে আটটি এবং হাইড্রোজেনের ক্ষেত্রে দুটি ইলেকট্রন সংখ্যা পূর্ণ করে যৌগের অণু গঠন করে তখন এইরূপ অণু গঠন করার ক্ষমতাকে সম যোজ্যতা বলে ।
সম যোজ্যতা গঠনের সময় একটি পরমাণু যত গুলি ইলেকট্রন জোড় গঠন করে সেই সংখ্যাটি হল সম যোজ্যতার পরিমাপ ।
সম যোজ্যতার প্রকার ভেদ :
সম যোজি বন্ধন তিন প্রকারের হয় । দুটি পরমাণুর মধ্যে একটি ইলেকট্রন জোড় গঠিত হলে বন্ধনটিকে এক বন্ধন বলে । একে '一' চিহ্ন দ্বারা প্রকাশ করা হয় ।দুটি পরমাণুর মধ্যে দুটি ইলেকট্রন জোড় গঠিত হলে দ্বিবন্ধন গঠিত হয় । একে'=' চিহ্ন দ্বারা প্রকাশ করা হয় । দুটি পরমাণুর মধ্যে তিনটি ইলেকট্রন জোড় গঠিত হলে ত্রিবন্ধন তৈরি হয় । একে'☰'চিহ্ন দ্বারা লেখা হয় ।
হাইড্রোজেন অনুর গঠন (H₂):

অনু গঠনের সময় প্রত্যেক টি হাইড্রোজেন পরমাণু একটি করে ইলেকট্রন দিয়ে এক জোড়া ইলেকট্রন গঠন করে এবং ওই ইলেকট্রন জোড় উভয় পরমাণু সমভাবে ব্যবহার করে । H₂ অণু তৈরি হয় ।
হাইড্রোজেন ক্লোরাইড (HCl) এর অণুর গঠন :

হাইড্রোজেন পরমাণু একটি ইলেকট্রন ও ক্লোরিন পরমাণু একটি ইলেকট্রন দিয়ে এক জোড়া ইলেকট্রন গঠন করে ।এই ইলেকট্রন জোড়কে উভয় পরমাণু সমভাবে ব্যবহার করে । হাইড্রোজেন পরমাণু বাহিরের কক্ষে 2 টি ইলেকট্রন ( নিষ্ক্রিয় মৌল He এর কাঠামো ) এবং ক্লোরিন পরমাণু তার বাহিরের কক্ষে 8 টি ইলেক্ট্রন ( He বাদে অন্য নিষ্ক্রিয় মৌলের ইলেকট্রন কাঠামো ) লাভ করে ।
জলের অণুর গঠন (H ₂O ) :

এখানে দুটি হাইড্রোজেন পরমাণুর প্রত্যেকটি একটি করে ইলেকট্রন দান করে দুই জোড়া ইলেকট্রন গঠন করে । এই দুই জোড়া ইলেকট্রন একটি অক্সিজেন পরমাণু ও দুটি হাইড্রোজেন পরমাণু সমভাবে ব্যবহার করে থাকে । বন্ধন গঠনের পরে অক্সিজেনের বাহিরের কক্ষে 8 টি এবং হাইড্রোজেনের বাহিরের কক্ষে 2 টি ইলেক্ট্রন হয় ।
মিথেন অণুর (CH₄) গঠন :
কার্বন পরমাণুর বাহিরের কক্ষে 4 টি ইলেকট্রন থাকে । এই চারটি ইলেকট্রন চারটি হাইড্রোজেন পরমাণুর ইলেকট্রনের সঙ্গে সমযোজী বন্ধন তৈরি করে ।
কার্বন ডাই অক্সাইড (CO₂) অণুর গঠন :
একটি কার্বন পরমাণু দুটি অক্সিজেন পরমাণুর প্রত্যেকটির সঙ্গে দুই জোড়া করে ইলেকট্রন জোড় গঠন করে ।ফলে প্রতিটি অক্সিজেন পরমাণু দুটি করে ইলেকট্রন জোড় এবং কার্বন পরমাণু 4 টি ইলেকট্রন জোড় সমভাবে ব্যবহার করে । কার্বন ও অক্সিজেন উভয় পরমাণুর বাহিরের কক্ষে 8 ইলেকট্রন সংখ্যা পূর্ণ হয় ।
নাইট্রোজেন (N₂) অণুর গঠন :
নাইট্রোজেনের বাহিরের কক্ষে 5 টি ইলেকট্রন থাকে । প্রতিটি পরমাণু 3 টি করে ইলেকট্রন দিয়ে 3 জোড় ইলেকট্রন গঠন করে যা উভয় পরমাণু সম ভাবে গ্রহণ করে তাদের বাহিরের কক্ষে 8 টি ইলেকট্রন পূর্ণ করে ।দুটি নাইট্রোজেন পরমাণু পরস্পর ত্রি বন্ধন দ্বারা যুক্ত হয় ।
সমযোজী যৌগের বৈশিষ্ট্য (Properties of covalent compounds):
1)ভৌত অবস্হা :সমযোজী যৌগের আয়নের কোনো অস্তিত্ত্ব নেই । অণুগুলির মধ্যে আকর্ষণ বল খুব কম । সেজন্য স্বাবাভিক চাপ ও উষ্নতায় সমযোজী যৌগ গুলি তরল ও গ্যাসীয় অথবা কোমল কঠিন হয় ।(যেমন মিথেন গ্যাসীয় ,ইথানল তরল এবং চিনি কঠিন )
2)গলনাঙ্ক ও স্ফুটনাঙ্ক : অণুগুলির মধ্যে আকর্ষণ বল কম হওয়ায় সমযোজী যৌগ গুলির গলনাঙ্ক ও স্ফুটনাঙ্ক আয়োনীয় যৌগের তুলনায় কম হয় ।
3)দ্রাব্যতা : সমযোজী যৌগ গুলি অধ্রুবীয় দ্রাবকে ( বেঞ্জিন ইত্যাদি ) দ্রবীভূত হয় । ধ্রুবীয়( জল )
দ্রাবকে দ্রবীভূত হয় না । )তড়িৎ পরিবাহিতা : যেহেতু সমযোজী যৌগ গুলি আয়নিত হয় না এগুলির জলীয় দ্রবণ তড়িৎ পরিবহন করে না ।
বহু বিকল্প ভিত্তিক প্রশ্নাবলী (MCQ): [ নীচের url টি কপি করে গুগল এর address bar এ paste কর এবং কুইজ টি open কর ]
https://forms.gle/ZbxvQRT8Sr3onqd4A
1) একটি ধ্রুবিও দ্রাবক হল
A) এলকোহল B) বেঞ্জিন C) জল D) কেরোসিনে
2) নিষ্ক্রিয় মৌলের পরমাণুর সবচেয়ে বাহিরের কক্ষে ইলেকট্রন সংখ্যা
A) 6 B) 7 C) 4 D) 8
3. আয়োনীয় বন্ধন গঠিত হয়
A) দুটি ভিন্ন ধাতব মৌলের পরমাণুর মধ্যে B) একটি ধাতব ও একটি অধাতব মৌলের পরমাণুর মধ্যে C) দুটি একই মৌলের পরমাণুর মধ্যে D) দুটি ভিন্ন অধাতব মৌলের পরমাণুর মধ্যে
4. নীচের কোন যৌগটির কঠিন অবস্থা আয়ন দ্বারা গঠিত ?
4. নীচের কোন যৌগটির কঠিন অবস্থা আয়ন দ্বারা গঠিত ?
A) সোডিয়াম ক্লোরাইড B) হাইড্রোজেন ক্লোরাইড C) ন্যাপথলিন D) গ্লুকোজ
5.নীচের কোনটিতে সমযোজী বন্ধন বর্তমান ?
A) HCl B) NaCl C) LiH D) CaO
6, একটি সমযোজী ত্রি বন্ধন যৌগ হল
A) H₂O B) CO₂ C) C₂H₂ D) CH₄
7. নীচের কোন যৌগটি গঠনের ক্ষেত্রে অষ্টক নীতি মান্য হয় না ?
A) NaCl B) LiH C) KCl D) CaO
8. কোনটির গলনাঙ্ক ও স্ফুটনাঙ্ক সবচেয়ে বেশি ?
A) CH₄ B) H₂O C) NaCl D) N₂
9.দ্রবীভূত ও গলিত অবস্থায় তড়িৎ পরিবহন করে না
A) NaCl B) NaF C) CCl₄ D) KCl
10. কোন যৌগটিতে স্বতন্ত্র অনুর অস্তিত্ব নেই ?
A) CO₂ B) C₂H₂ C) CH₄ D) CaO



ফিজিক্স কেমিস্ট্রি সব ভুলে গেছি। কিন্তু এইগুলো আবার পড়তে খুব ভালো লাগছে। খুব সুন্দর করে বোঝানো হয়েছে। নতুন করে ইলেক্ট্রোভ্যালেন্ট আর কোভ্যালেন্ট পড়ে মনে পড়ে গেল পুরনো লেখাপড়া। CaO উদাহরণের ছবিতে অক্সাইড আয়নের বিন্যাসে একটা ছাপার ভুল আছে বলে মনে হচ্ছে। কিংবা আমি হয়ত না বুঝেই বলছি। 2,8,8 লেখা হয়ে গেছে। ওটা কি 2,8 হবে?
উত্তরমুছুনCa এর পারমানবিক সংখ্যা 20 (2+8+8+2) সুতরাং Ca আয়নের ইলেকট্রন বিন্যাস হবে 2+8+8
উত্তরমুছুন